尽管有大量用于检测和治疗癌症的纳米探针,但外科手术(通常通过成像辅助)仍然是去除原发肿瘤和某些转移性肿瘤的主要手段。整合多种成像和治疗方式的可肾脏清除的纳米探针在临床上可能是有益的。然而,开发这样的治疗药物多模态纳米探针是具有挑战性的,因为多组分治疗药物制剂通常具有复杂的制备方法,缺乏精确的治疗方案并且显示出差的生物相容性和生物降解性。在这方面,金纳米粒子是有优势的,因为它们的表面等离子体共振特性可以通过改变纳米粒子的尺寸和形态来调节。它们固有的生物相容性和易于功能化的特性,使其成为光声成像,荧光(FL)成像,计算机断层扫描(CT)成像和磁共振成像(MRI)的造影剂;并且因为它们还可以整合多种治疗功能。理想情况下,此类“多合一”的诊疗纳米颗粒应通过绿色工艺合成,以降低生物毒性。
成果简介
近日,纪念斯隆-凯特琳癌症中心Moritz Kircher等人报告了一种超小型金纳米团簇的一步绿色合成和诊疗应用,其中金纳米团簇通过乳蛋白α-乳清蛋白(α-LA;作为温和的还原剂)来稳定。这些纳米团簇很容易被肾脏清除,为FL/MRI/CT三模成像提供对比(如在带有乳腺异种移植物或患者来源的异种移植物的小鼠中所示),并有助于肿瘤的图像引导手术切除。纳米团簇的多功能性、生物相容性和安全性使其成为转化开发的理想候选材料。
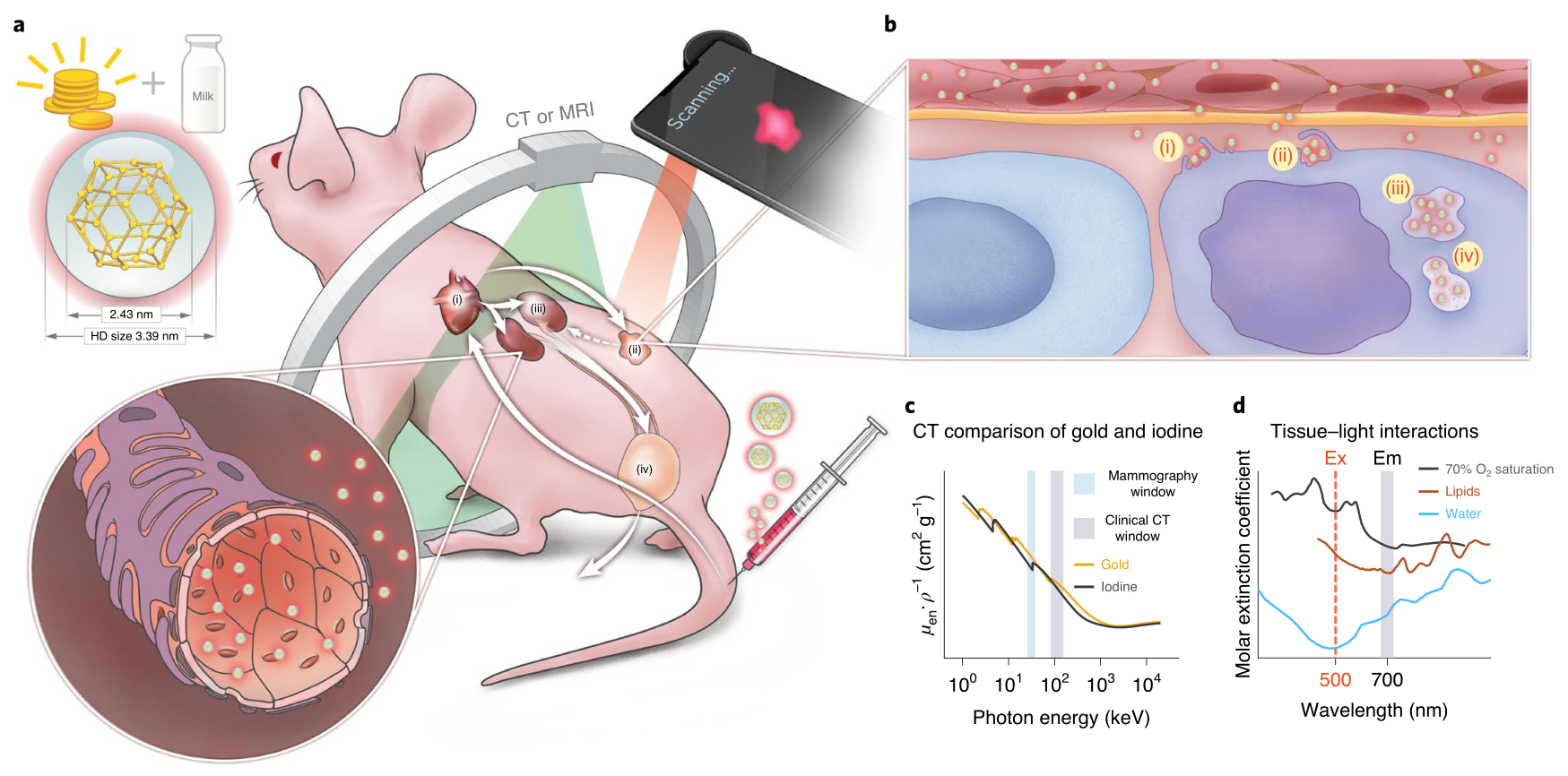
图|肾脏可清除AuQC705的用于癌症成像的概念
相关成果发表在Nature Biomedical Engineering上。其中美国国家卫生研究院陈小元、深圳大学黄鹏教授等人受邀发表重要评述!


一箭三雕!
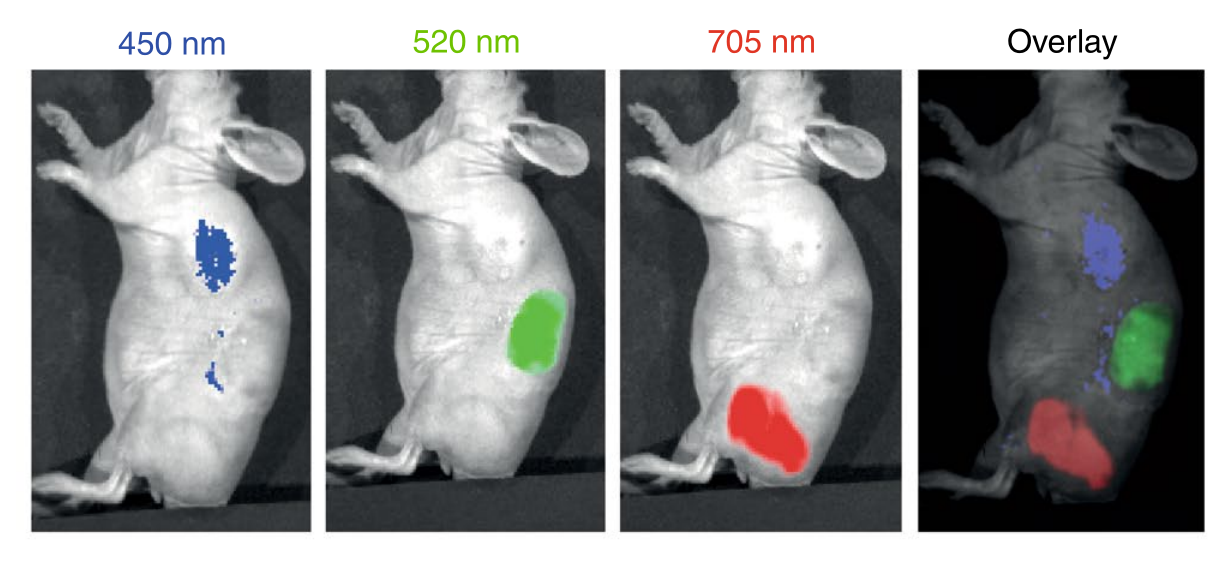
通过改变配体浓度、pH值和反应时间,研究人员设计了三种类型的纳米团簇,在相同的激发波长(430nm)下显示三个荧光发射峰(波长分别为450、520和705 nm,分别对应蓝色、绿色和红色,AuQC450, AuQC705 and AuQC520)。作为组合使用原则的证明,作者展示了三种小鼠皮下肿瘤的同时成像(通过背景组织自身荧光的光谱分解),每个肿瘤注射一种纳米团簇。
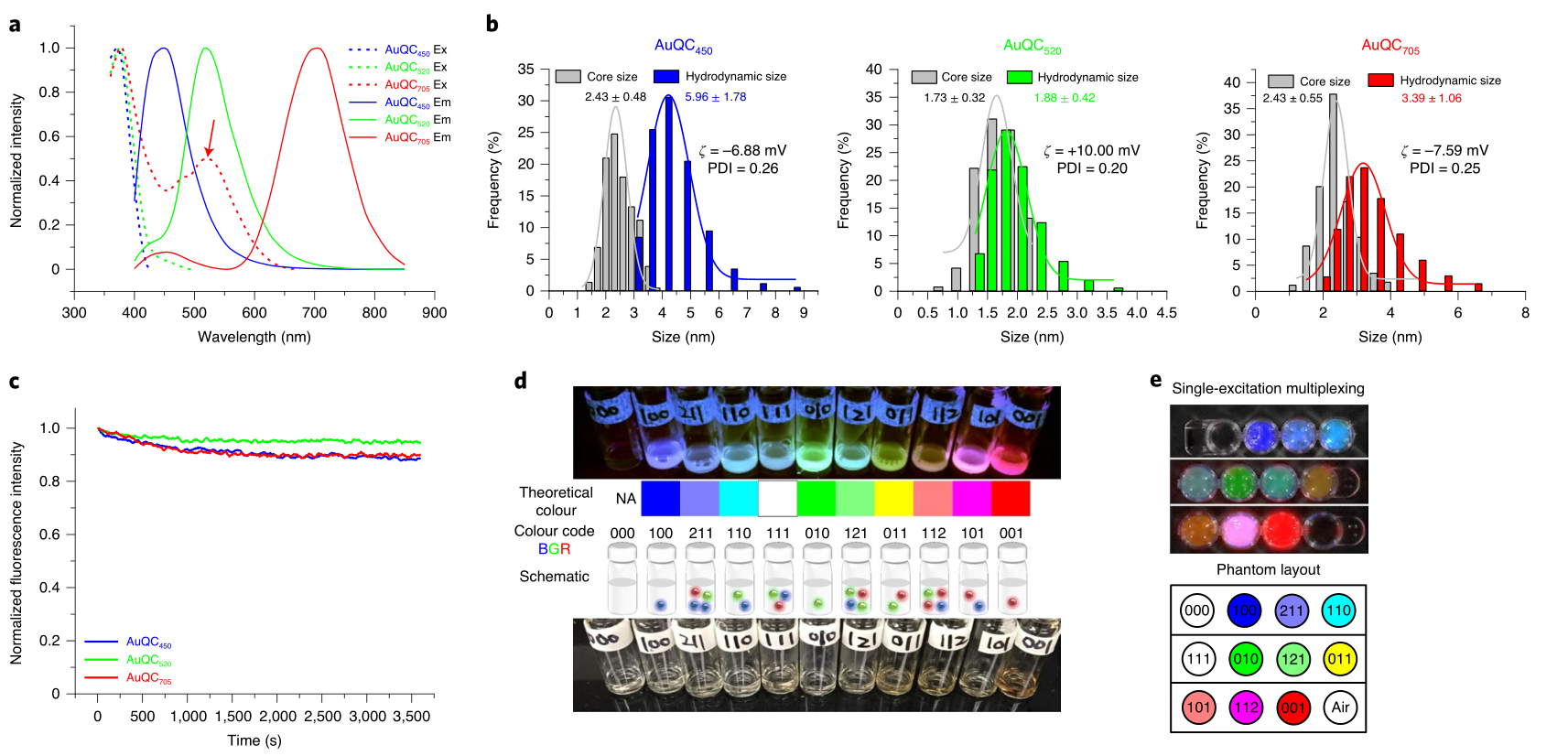
AuQC的表征
三模态图像引导
作者还表明,发射近红外(NIR)荧光(705nm)的纳米团簇可以在智能手机相机上用改进镜头拍摄的图像引导下,切除位于小鼠乳腺脂肪垫附近的肿瘤。此外,由于纳米团簇具有很强的磁弛豫性,因此在具有肿瘤异种移植物的小鼠中静脉注射NIR纳米团簇可以通过CT和FL成像获得互补的宏观和微观信息。总的来说,高灵敏度和良好的时间和空间分辨率的结合使纳米团簇适合于三模态图像引导。
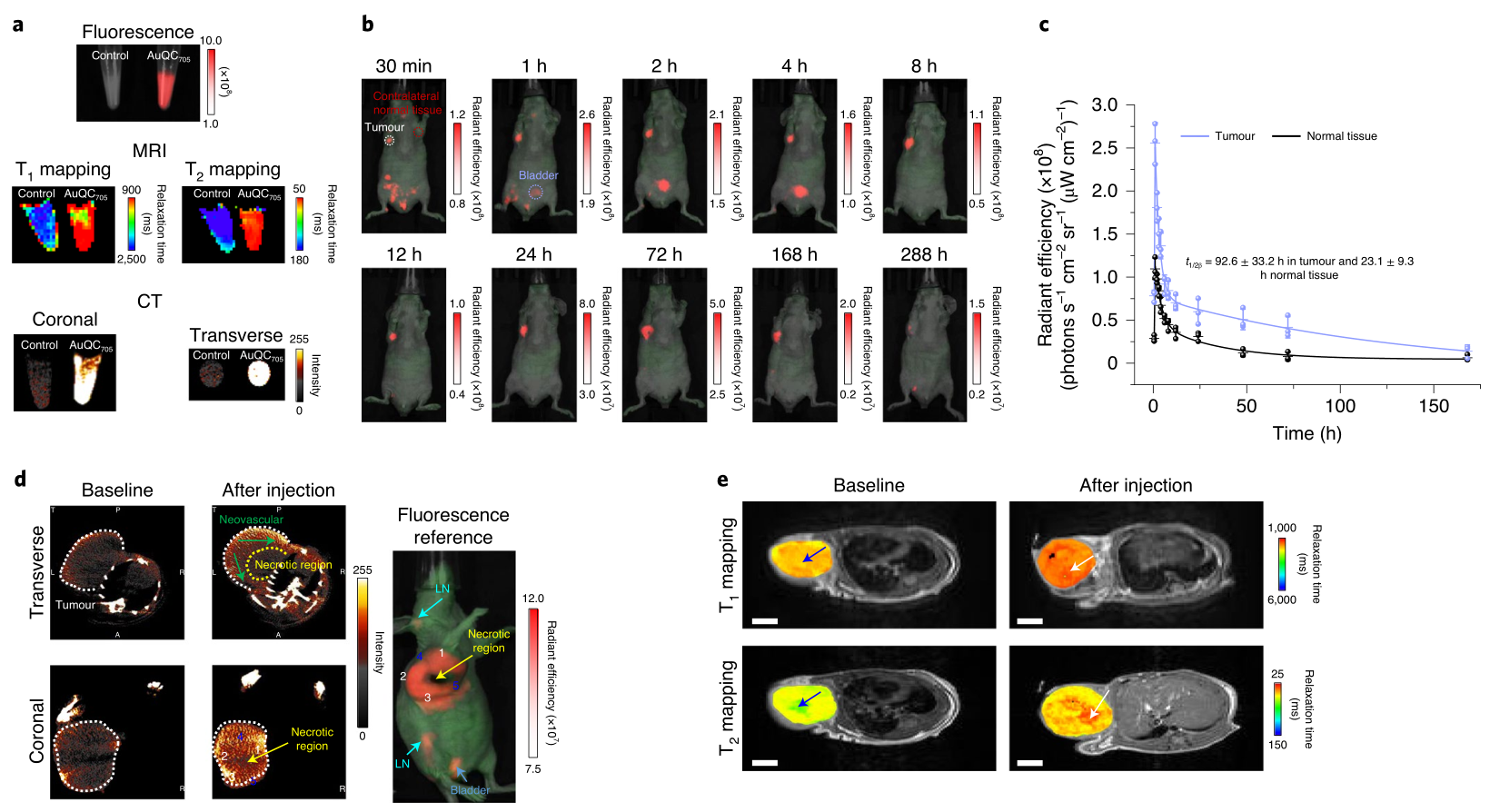
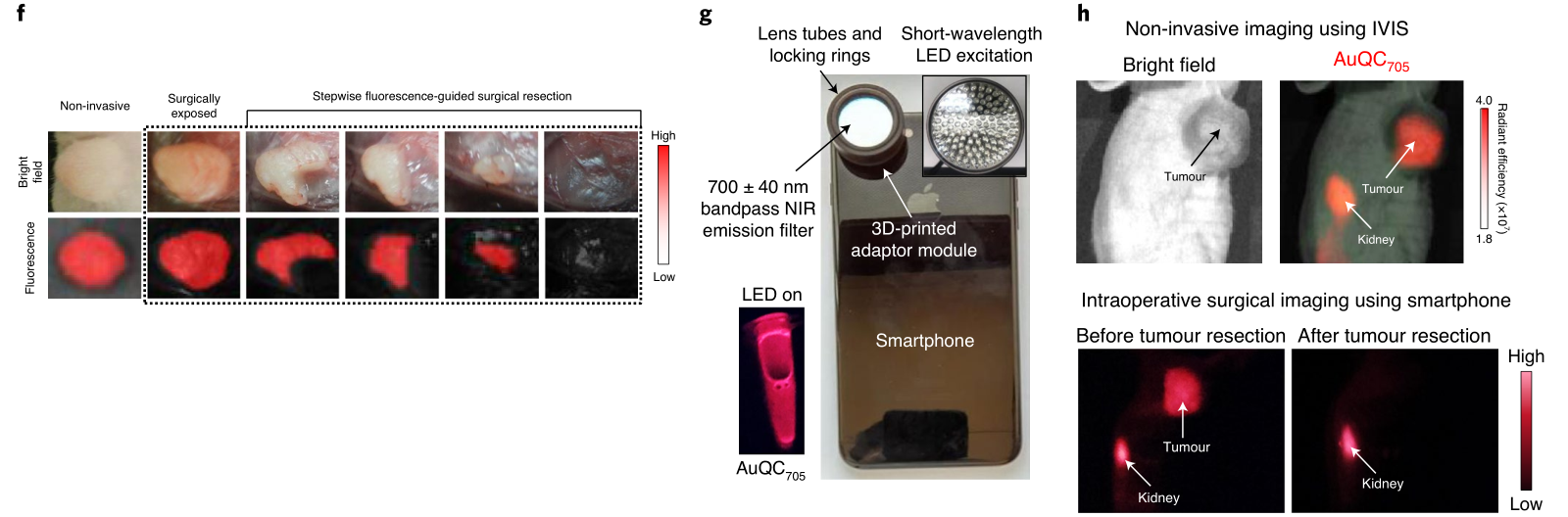
图|AuQC705可对活小鼠的乳腺癌细胞和肿瘤成像
与牛奶成分结合!
此外,根据观察,在母乳喂养的母亲和婴儿中癌症的发病率均较低,抗癌药物HAMLET与人乳中分离出的抗癌药物HAMLET与牛α-LA对人肿瘤细胞致死性(BAMLET)相当。研究人员使用球状金属蛋白α-乳清蛋白(α-LA)来合成AuQCs,这不仅是因为其分子量低于普通的载体蛋白,而且还因为它是抗癌脂蛋白复合物的蛋白成分。此外,它是天然存在的膳食蛋白质分子,因此被FDA通常认为是安全的。α-LA具有与多种金属离子的高亲和力结合位点,并与溶菌酶共享结构相似性,而溶菌酶与Au3+结合形成NP。
抗肿瘤机制
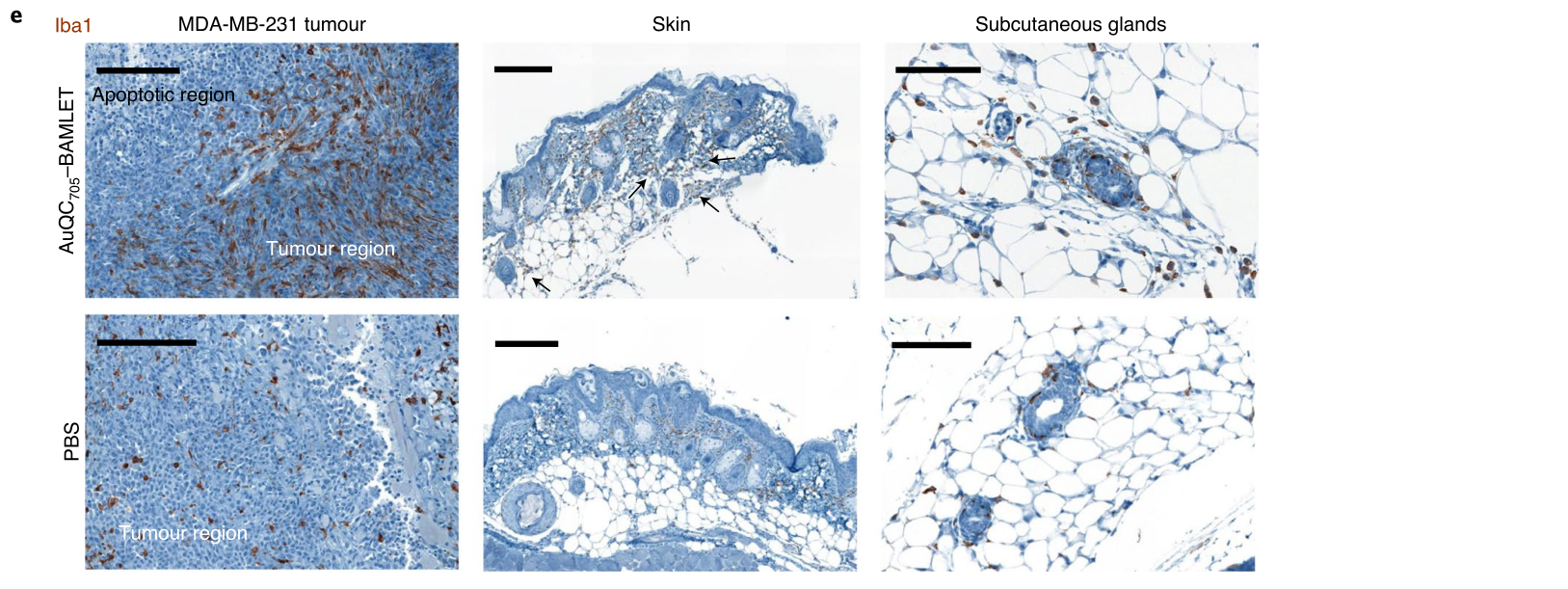
在携带原位三阴性乳腺癌肿瘤的小鼠中,金纳米团簇/BAMLET复合物通过钙网蛋白的快速表面易位,诱导浸润巨噬细胞进入肿瘤组织,并驱动巨噬细胞免疫刺激激活,导致免疫原性癌细胞死亡。这种免疫反应由α-LA蛋白的去折叠程度决定,并可被抗α-LA抗体减弱。作者还表明,肿瘤发生过程中的信号传导途径(特别是丝裂原活化蛋白激酶(MAPK)途径和磷酸肌醇-3-激酶(PI3K)/蛋白激酶-B途径)是该复合物的靶点。此外,这种复合物选择性地聚集在肿瘤坏死区域(通过FL成像可以看到并得到组织学的证实),因此,它可以提供关于肿瘤内药物分布的信息
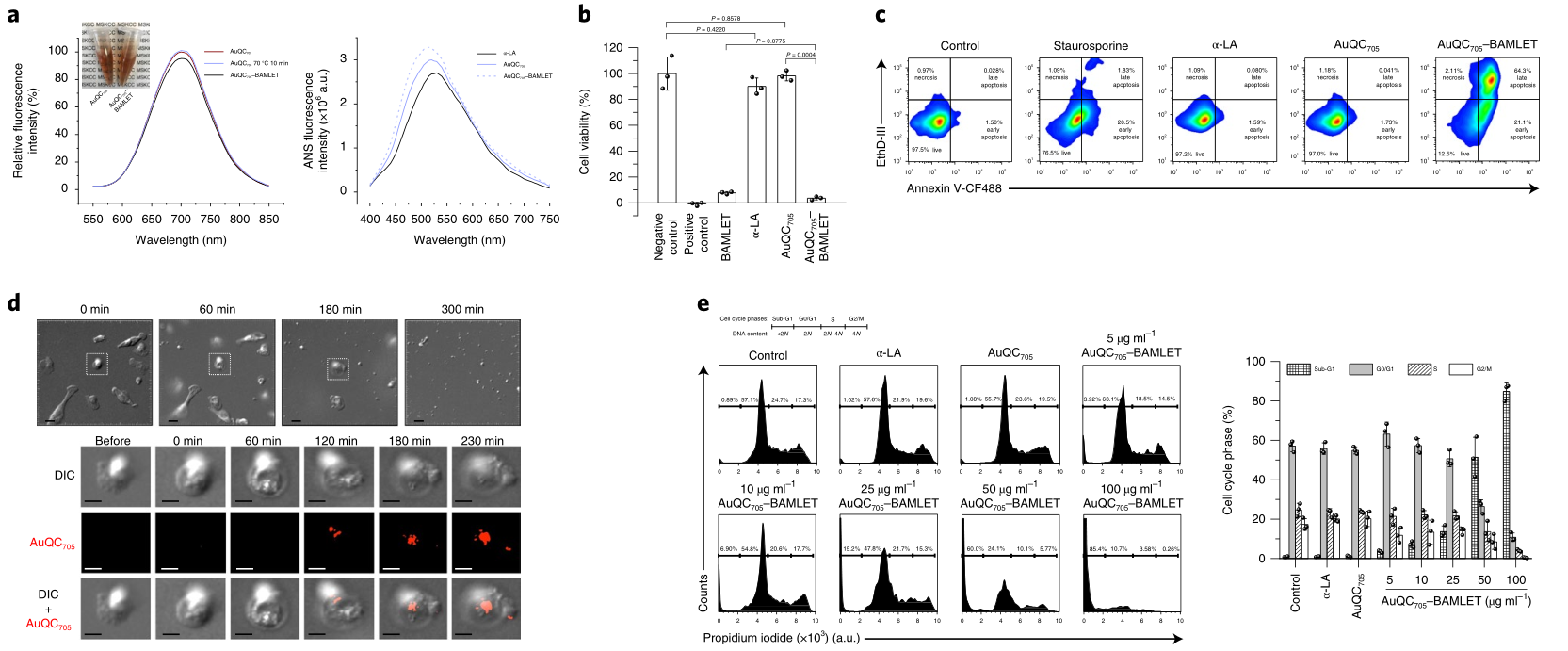
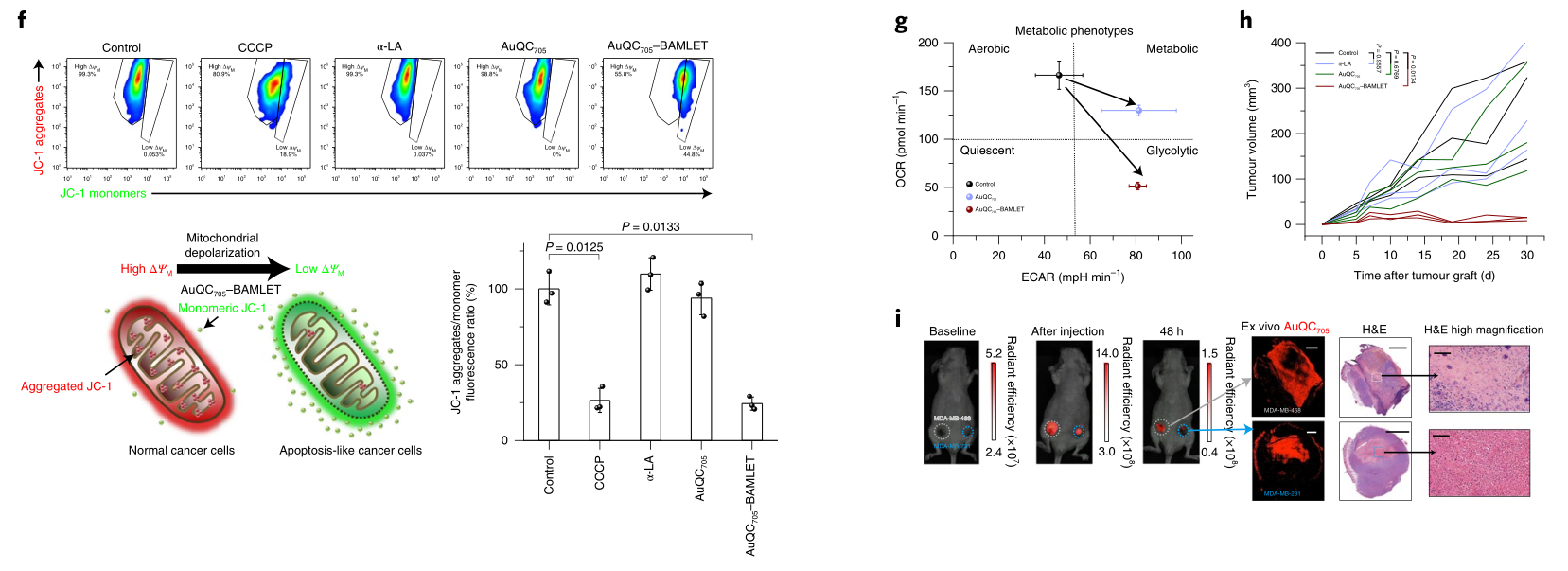
图|AuQC705–BAMLET是有效诱导癌细胞死亡的纳米复合物
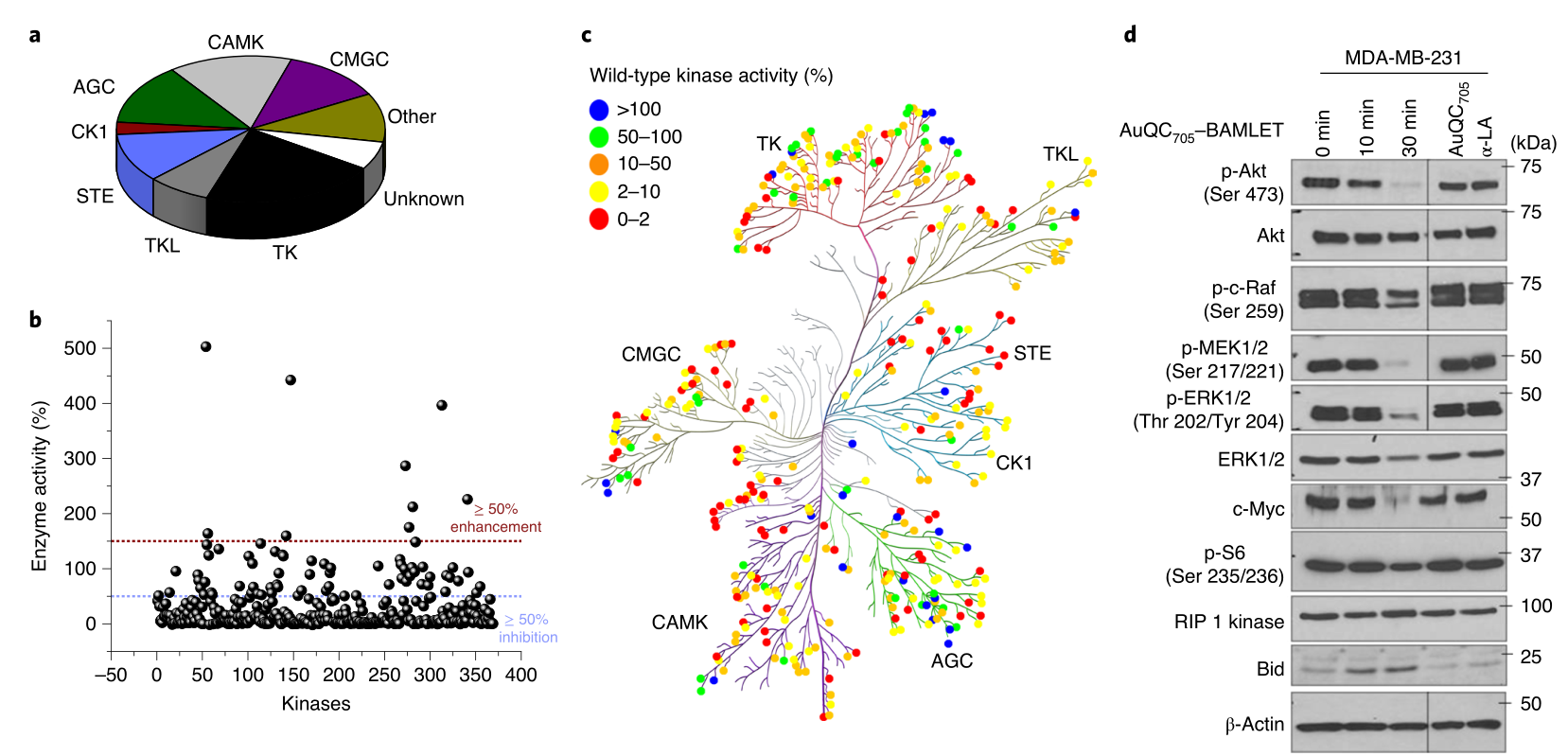
图|抗癌AuQC705–BAMLET脂蛋白纳米复合物的分子机制
总结与展望
因此,金/α-LA纳米簇是一种用途广泛的治疗剂。但是,它们是被动的,依赖于肿瘤组织增强通透性和滞留(EPR)效应(它们通过巨胞饮作用进入,这是一种涉及吞噬少量细胞外培养基的非特异性细胞摄取机制)。通过修饰金/α-LA纳米簇表面上的靶向癌症的配体(例如叶酸或抗体),有望提高成像分辨率和治疗效果。
另外,为了评估纳米簇在临床上的适用性,需要大规模生产可靠的合成方案,以确保局部pH和氨基酸浓度以及α-LA的反应性,反应时间乃至构象变化满足批次间的一致性阈值。尽管金纳米颗粒的毒性应忽略不计,但该复合物仍需在大型动物中进行临床前毒理学测试。更一般而言,纳米药物的开发应涉及与特定临床情况相关的明确定义的目标,并且治疗性纳米颗粒需要通过定性和定量多模态成像的标准性能评估方法。最终,除非多模式成像硬件、图像采集算法和图像数据注册共同开发和优化,否则纳米团簇将无法用于手术室精确的图像引导肿瘤切除。
参考文献:
1.Yang, J., et al. Gold/alpha-lactalbumin nanoprobes for the imaging andtreatment of breast cancer. Nat Biomed Eng 4, 686–703 (2020).
https://doi.org/10.1038/s41551-020-0584-z
2.He, G., Huang, P. & Chen, X. Theranostic multimodal gold nanoclusters. NatBiomed Eng 4, 668–669 (2020).
https://doi.org/10.1038/s41551-020-0588-8











