红细胞占人体细胞的80%以上,起着向组织输送氧气的主要功能。除氧气运输外,红细胞还具有多种与免疫学高度相关的附加功能。例如,一旦达到其自然寿命,衰老的红细胞在脾脏中以非炎症途径被吞噬。这一独特的机制已经被巧妙地开发用于自身免疫性疾病和减少抗药物抗体产生的抗原耐受性。具体地说,附着在红细胞膜上的抗原肽与衰老的红细胞一起被捕获在脾脏中,由于红细胞固有的捕获的非炎性途径,因此对抗原产生了耐受性应答。
近来,红细胞涉及到另一种有趣的、相反的先天免疫功能。具体而言,它们捕获循环的免疫复合物和细菌在其表面上,并将其交给肝脏中的库普弗细胞和脾脏中的专业抗原呈递细胞(APCs),而不会捕获载体红细胞。血液中的细菌物种(如葡萄球菌和丙酸杆菌)由于静电吸引而附着在红细胞膜上,并通过载体红细胞的oxycytosis(氧化摄取)作用而被杀死。此后,红细胞将其移交给肝脏和脾脏中的细胞,而不会被隔离。虽然尚不清楚APCs选择性摄取货物的确切机制,但细菌性货物诱导的瞬时膜改变与红细胞和APCs之间串扰增加有关。
分子附着在红细胞上已被用于多种生物医学应用。一系列的有效载荷,包括蛋白质、治疗药物和纳米颗粒被附着在红细胞表面或包裹在红细胞内,用于各种治疗应用。通过化学结合、与特定受体(如糖蛋白A)结合、分选或被动吸附,将货物附着到红细胞表面,而不会损害其氧转运的生理功能。以前所有的红细胞搭便车的方法都是基于对载体红细胞的最小扰动诱导,这导致红细胞的循环延长或在注射后被捕获在毛细血管内皮中。
成果简介:
鉴于此,美国两院院士、哈佛大学教授Samir Mitragotri等人利用红细胞固有的独特能力在脾脏中呈递抗原,从而开发出仿生策略来产生针对抗原的细胞和体液免疫反应(图1)。即研究人员设计了一个搭便车系统,诱导附着的纳米颗粒主要输送到脾脏而不是肺部,从而实现细胞免疫和体液免疫,这一过程称之为红细胞驱动的免疫靶向(EDIT)。相关成果发表在国际顶级期刊PNAS上。
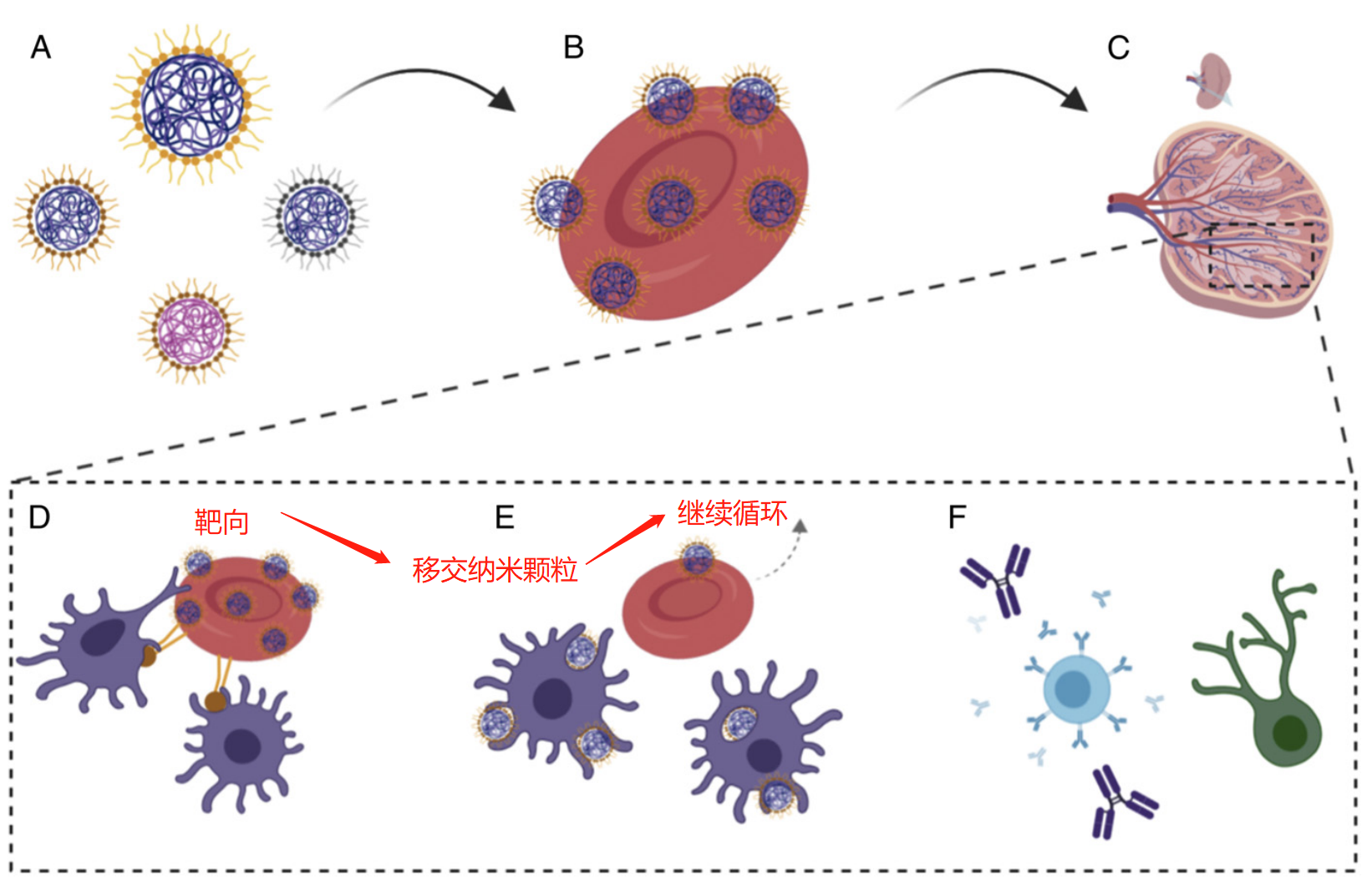
示意图
整体合成步骤
研究人员选择卵清蛋白(OVA)作为模型抗原,并使用EDC化学方法将其覆盖在200 nm聚苯乙烯羧酸盐(PS-COOH)的表面上,以生成附着在红细胞上的蛋白质封端的纳米颗粒(NP)。所有颗粒都是单分散的,并且能很好地被树突状细胞内化,且可以活化树突状细胞。
纳米颗粒的搭便车通过两个物理步骤来实现:纳米颗粒吸附在红细胞表面以引发接触,以及膜在纳米颗粒周围的扩散以增强粘附强度。其中任何一个都是不够的。如果纳米颗粒不与红细胞接触,粘附就不会启动;如果膜扩散受到抑制,则粘附力较弱,纳米颗粒在洗涤过程中会脱落。在附着过程中引入竞争蛋白(血清)基本上抑制了搭便车。
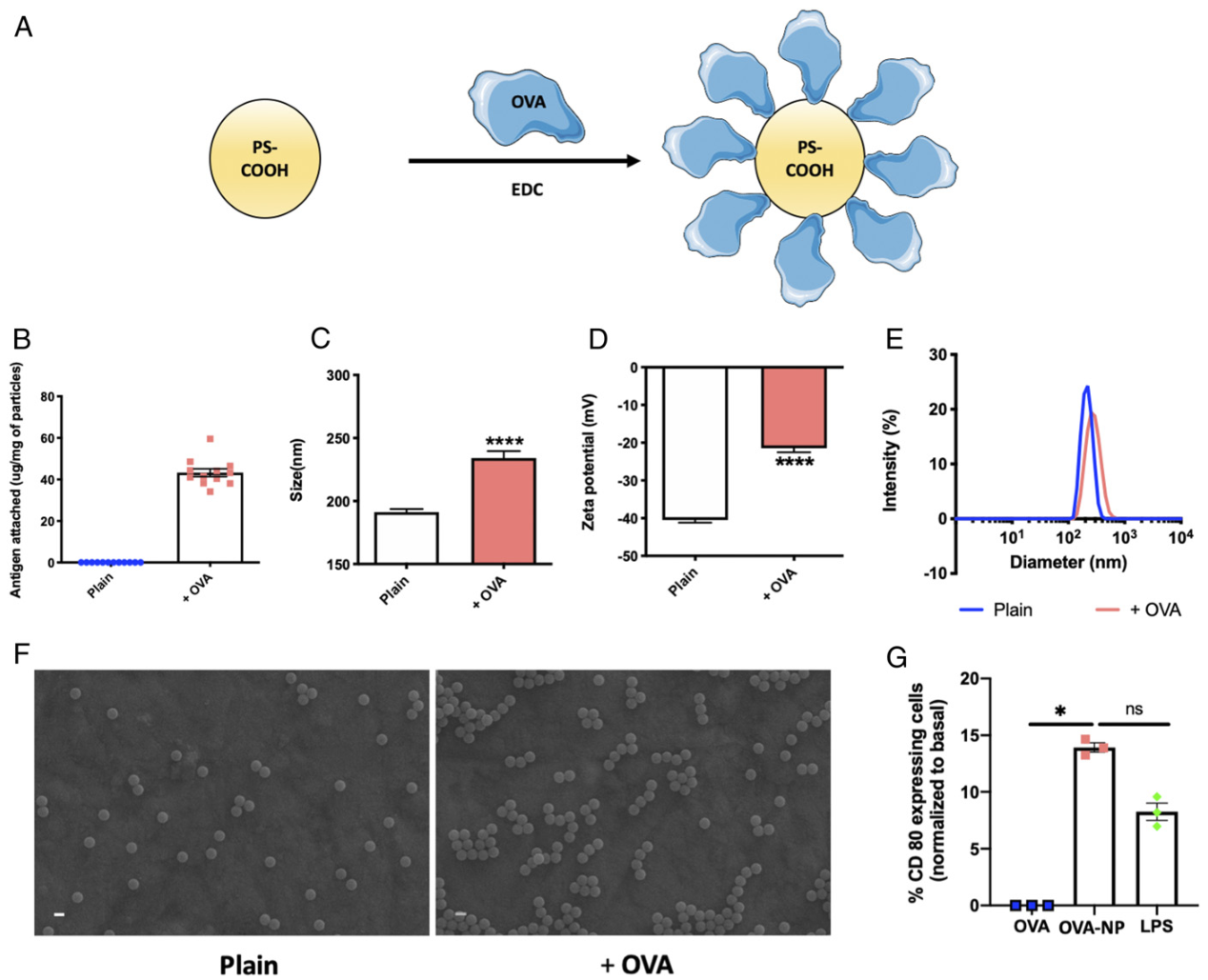
图|蛋白质封端的纳米颗粒的表征
多颗粒致硬而耐剪切
传统上,红细胞搭便车被用于肺靶向应用,因为肺毛细血管中拉伸的红细胞所经受的剪切应力能够将肺部的颗粒物去除。这使得将货物运送到脾脏具有挑战性。改变纳米颗粒从肺到脾的分布的主要因素是纳米颗粒与红细胞的初始投料比。调节这一参数有助于改善肺部的剪切阻力,从而允许较小比例的纳米颗粒在肺部分离,并使更多的纳米颗粒可用于其他地方的靶向。同时,红细胞膜的轻微改变使脾脏成为天然靶点。
体外剪切研究表明,增加NP:红细胞饲料比可以显著减少剪切诱导的脱离。更高的NP:红细胞饲料比的高纳米颗粒密度可能是这种抗剪切性能提高的原因。高负荷的红细胞更加坚硬,从而抵抗肺毛细血管的生物力学拉伸,从而减少肺的积聚。该系统通过控制饲料中NP:红细胞比率和评估磷脂酰丝氨酸上调的暂时性损伤来实现这一特性。磷脂酰丝氨酸上调被认为可以促进树突状细胞与红细胞的相互作用。
红细胞膜继续循环!
基于NP:红细胞比例对体外剪切阻力和瞬时磷脂酰丝氨酸表达的影响,选择了最佳的NP:红细胞比例为300:1。本研究的颗粒仅递送至脾脏,而红细胞继续保持循环,表明对红细胞膜的损害是暂时的,足以进行脾脏的移交,但不会使红细胞本身被隔离。吞噬细胞耗竭研究表明,脾脏中的颗粒并不位于吞噬细胞内,这表明它们存在于APCs中,可用于免疫调节。
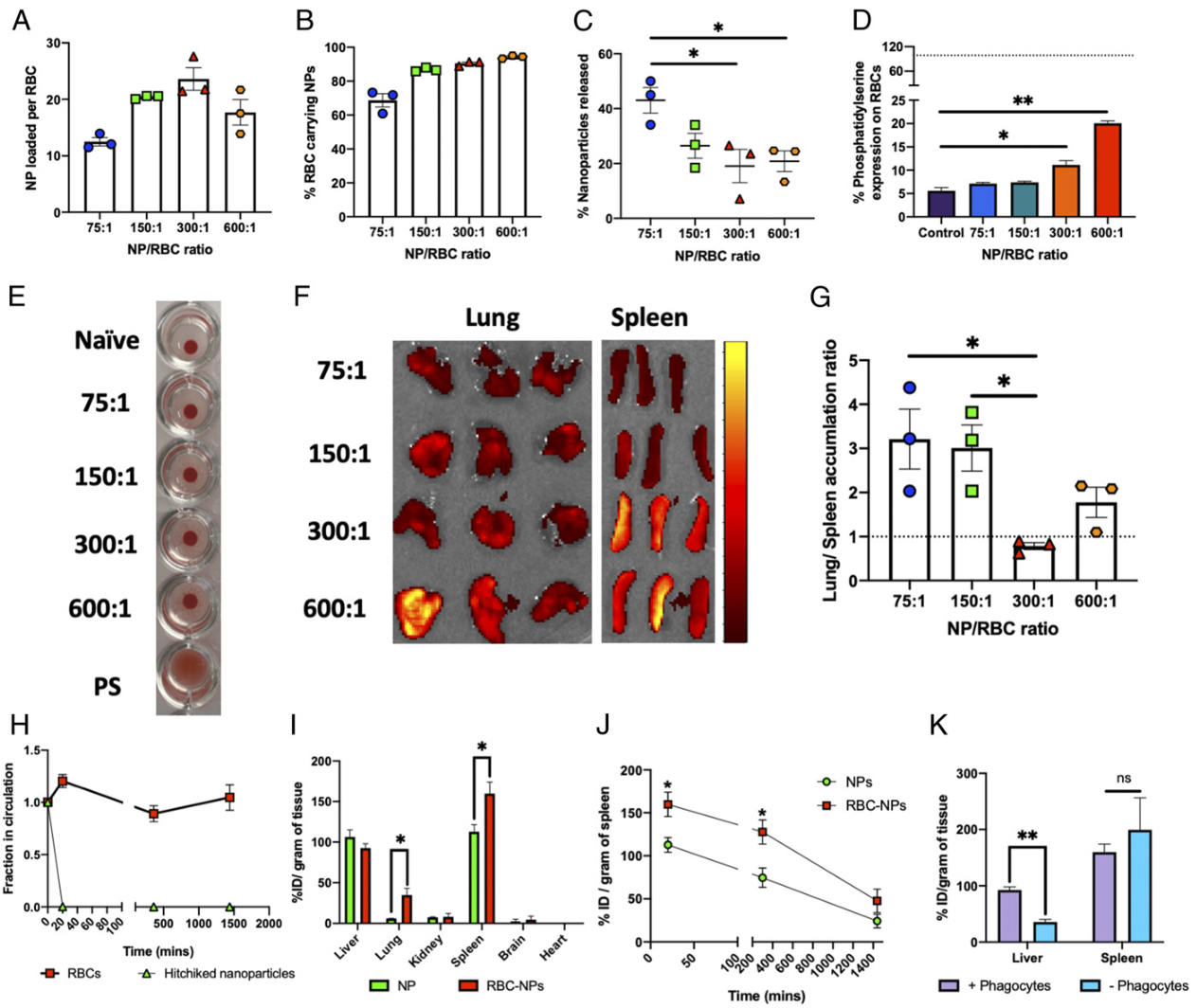
图|工程化纳米粒子-红细胞-搭便车参数以实现脾脏靶向
强大体液和细胞免疫反应
为了对体液和细胞免疫应答进行治疗性评估,在给予治疗并监测治疗结果后,分别接受了OVA挑战。因此,通过这些实验的设计,研究人员能够追踪对预防性疫苗接种的记忆反应。体液和细胞免疫反应显示出强大的疫苗接种潜力,与游离纳米粒子相比,EDIT抗体滴度高3倍,抗原经历的中央记忆T细胞高2.2倍,调节性T细胞低2.5倍。此外,通过酶联免疫吸附测定(ELISA)(针对抗OVA IgG抗体)和特异性细胞杀伤测定(针对脾细胞的细胞毒性)评估了结果,表明这些反应具有高度特异性。
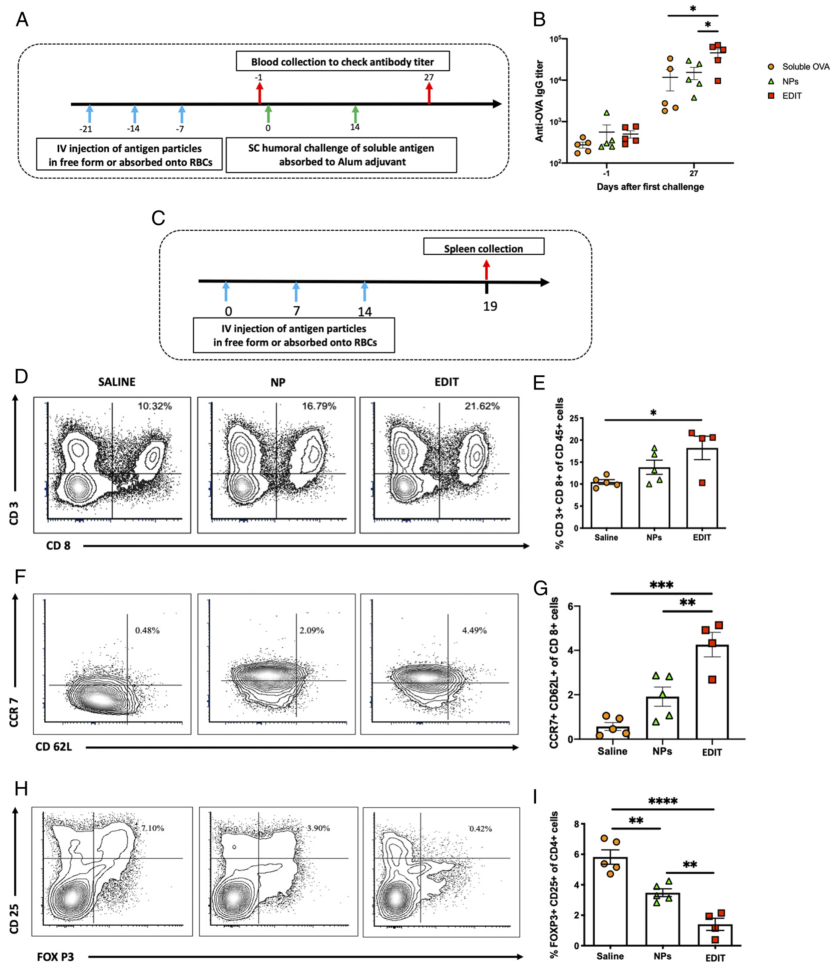
图|纳米粒子脾脏移交的免疫学结果
优于CpG
作为概念的证明,由EDIT产生的免疫反应已成功用于预防模型中的治疗反应。EDIT介导的免疫能够通过增加癌症免疫周期的平衡阶段来显着减慢肿瘤的生长,其表现与外来佐剂CpG一样好,从而增加了治疗干预的范围。在CpG和EDIT的策略之间可以注意到一些差异。与非天然分子CpG不同,此处的RBC是体内的天然细胞类型。此外,CpG通常与疫苗混合,从而使其从注射部位扩散开。相反,只有当纳米颗粒附着在受扰动的红细胞上时,EDIT才有效。最后,研究证实EDIT可以合并200 nm PS以外的纳米颗粒,包括不同尺寸的纳米颗粒、合成材料或生物材料。
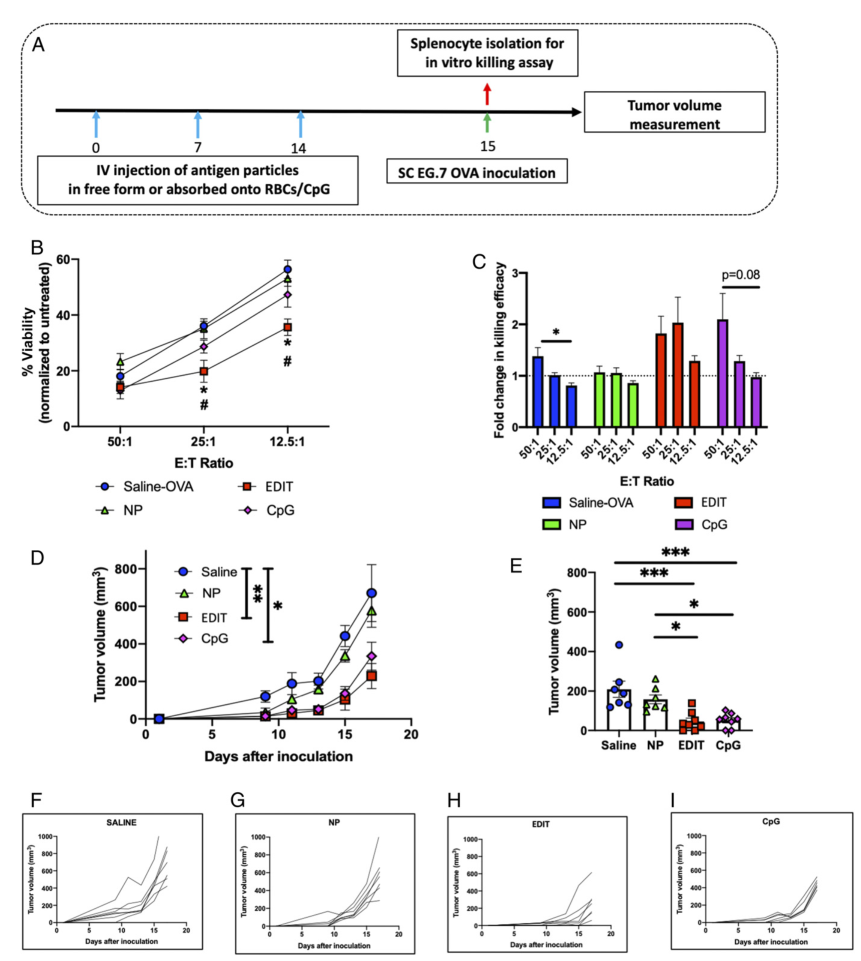
图|搭车纳米颗粒疫苗免疫调节的治疗扩展
小结:
基于人体“自我”细胞的无佐剂疗法代表了推动疫苗研发的独特方式。虽然未来的研究可以集中于理解EDIT与其他佐剂之间的异同,但其他佐剂的可用性,尤其是基于自身的佐剂,如受干扰的红细胞,可能会极大地有益于从事佐剂和疫苗研究的科学界。
综上所述,已经开发了一种仿生策略,该策略利用了红细胞的先天免疫功能来设计有效的纳米颗粒向脾脏的转移。从根本上讲,它代表了将纳米颗粒输送到脾脏的另一种途径,该途径不涉及对纳米颗粒本身的大量修饰。EDIT进行的纳米粒子传接导致强大的免疫记忆,可以驱动治疗反应。通过进一步的研究和进行更具体的免疫学研究,该平台可以用作一种通用策略,无需经过特殊修饰即可将几种现成的纳米粒子靶向脾脏。
值得注意的是,今年4月份,Mitragotri课题组为巨噬细胞背着一个可以分泌细胞因子的“背包”颗粒,使得巨噬细胞在到达肿瘤部位后,可以保持杀死肿瘤的状态长达5天,并已经发现在具有侵袭性乳腺癌的小鼠中可以减缓肿瘤生长和减少转移,相关成果于发表在4月29日发表在Science Advances上。(深度解读)
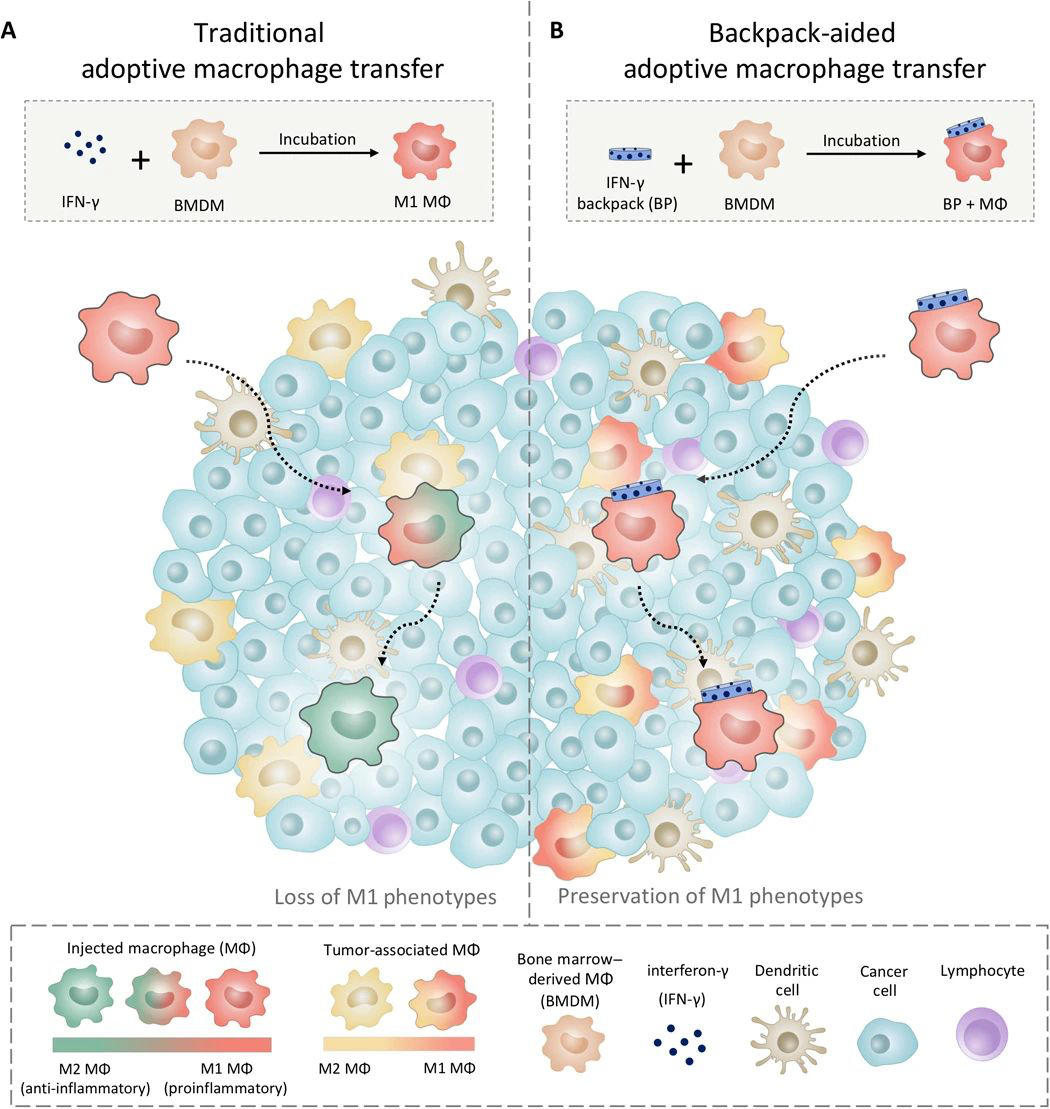
图自Science Advances
参考文献:
AnvayUkidve el al., Erythrocyte-driven immunization via biomimicry of their naturalantigen-presenting function, PNAS (2020).
https://doi.org/10.1073/pnas.2002880117











