肿瘤放射治疗(RT)是利用放射线治疗肿瘤的一种局部治疗方法。放射线包括放射性同位素产生的α、β、γ射线和各类x射线治疗机或加速器产生的x射线、电子线、质子束及其他粒子束等。大约70%的癌症患者在治疗癌症的过程中需要用放射治疗,约有40%的癌症可以用放疗根治。放射治疗是恶性肿瘤治疗中最常用的方法之一,临床上常与放射增敏剂联合应用以提高治疗效果。以下为奇物论编辑部针对近期最新发表在顶刊上的关于光热致敏放疗的研究和综述论文进行整理,供大家学习和交流!1. Adv. Drug. Deli. Rev:热疗可以改变肿瘤生理以提高化疗和放疗的疗效
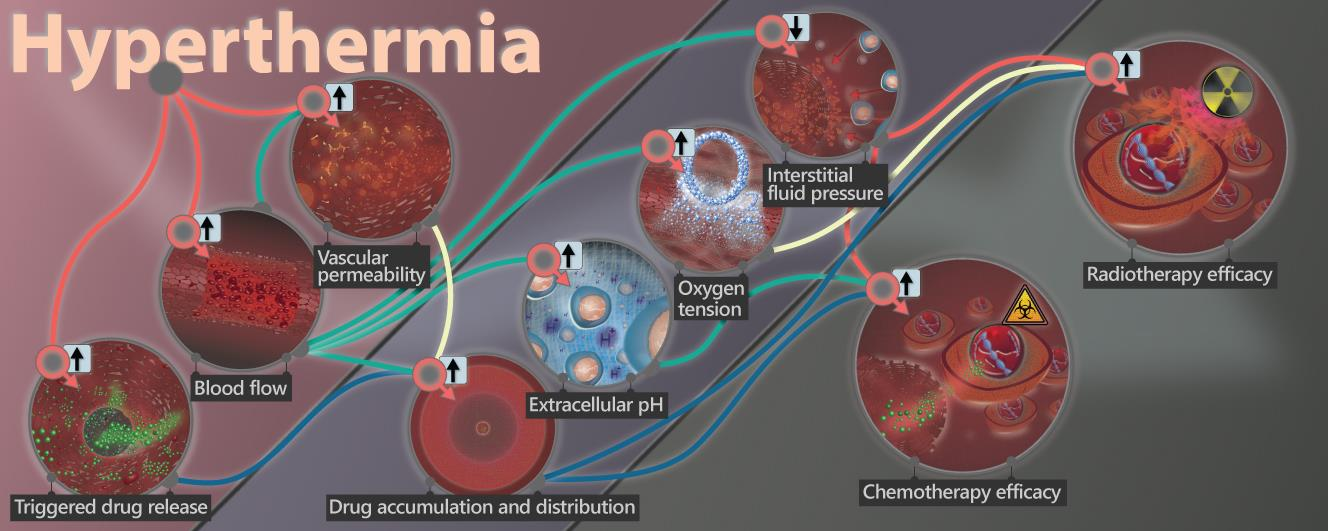
多伦多大学Michael Dunne对利用热疗改变肿瘤生理状况以提高化疗和放疗的效果的相关研究进展进行了综述介绍。(1)热疗已被证明在可以临床上成功地提高化疗和放疗对实体肿瘤的疗效。临床前和临床研究表明,靶向热疗能够以依赖于温度和时间的方式增加肿瘤内的血流灌注,而肿瘤内血液循环的改变可引起明显的生理变化,包括血管通透性增强、乏氧改善、组织间液压降低、生理pH值恢复正常等。(2)肿瘤内发生的这是生理上的变化可以积极地影响小分子和纳米化疗药物在肿瘤内的积累和分布,同时也能够提高对放疗敏感的肿瘤比例。并且,热疗也可以触发热敏试剂的药物释放,从而进一步改善化疗药物的在瘤内的积累、分布和疗效。Michael Dunne. et al. Hyperthermia can alter tumor physiology and improve chemo- and radio-therapy efficacy. Advanced Drug Delivery Reviews. 2020https://www.sciencedirect.com/science/article/pii/S0169409X203008312. Biomaterials:辐射前后轻度热疗可使放射治疗更加敏感

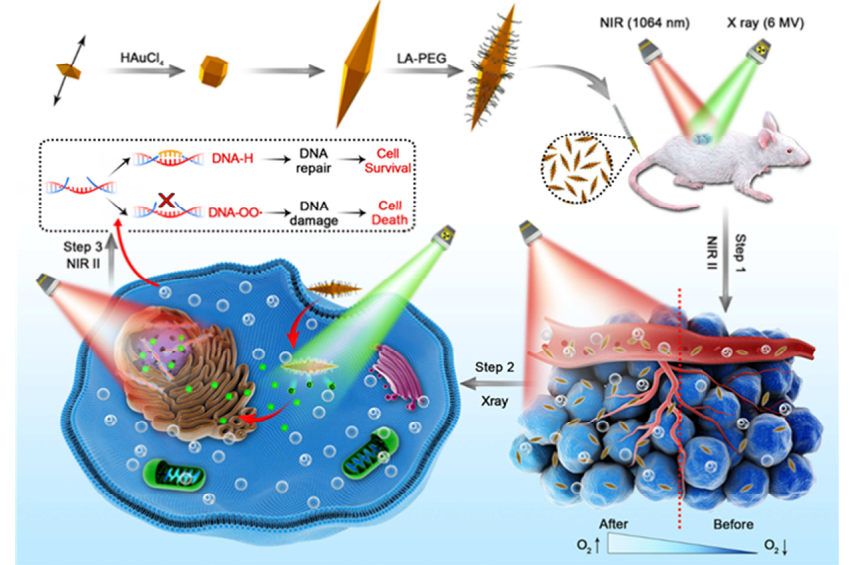
低氧诱导的放射抵抗、DNA损伤不足和多种DNA修复机制严重阻碍了肿瘤放射治疗的临床应用。在此,中国科学技术大学王育才、中山大学姚燕丹等人展示了一种双热疗策略,通过减轻肿瘤缺氧和防止辐射诱导的DNA损伤修复来加强放射治疗。1)以聚乙二醇化纳米双锥(PNBys)为光换能器,近红外激光能很好地控制肿瘤热疗温度,且副作用极小。2)PNBys在NIR-II窗口具有窄的纵向局域表面等离子体共振峰,具有较高的消光系数(2.0×1011M-1 cm-1)和良好的光热转换效率(44.2%)。3)放疗前PNBys诱导的轻度热疗(MHt)可以使血管扩张、血液灌注和缺氧缓解,从而增加肿瘤细胞对放射治疗的敏感性。另一方面,放疗后的MHt抑制辐射引起的DNA损伤的修复。4)在小鼠乳腺肿瘤EMT-6模型中,PNBys通过联合放疗前后的MHt发挥出层次性优越的抗肿瘤作用。因此,不同于单纯的RT和MHt的结合,PNBys将MHT前后与RT的结合开辟了一条新的有前景的抗癌途径。Quan Li, et al. Pre- and post-irradiation mild hyperthermia enabled by NIR-II for sensitizing radiotherapy, Biomaterials, 2020.https://doi.org/10.1016/j.biomaterials.2020.1202353. Biomaterials:ROS致敏放疗与纳米光疗联合治疗彻底根除原位乳腺癌并抑制转移

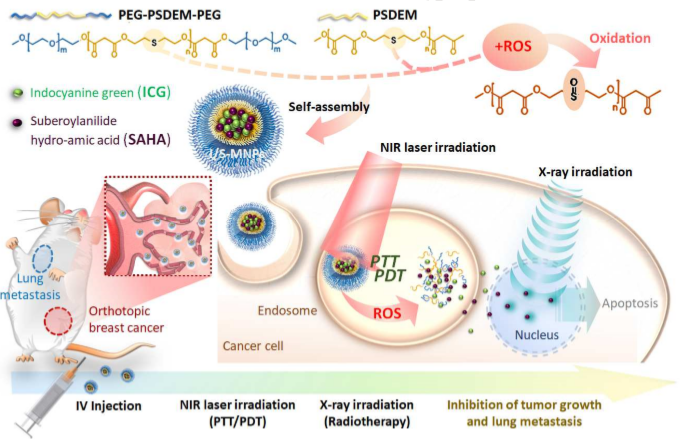
放射治疗(RT)是恶性肿瘤治疗中最常用的方法之一,临床上常与放射增敏剂联合应用以提高治疗效果。为了开发一种利用局部组织对光介导反应的反应,及使用ROS诱导的RT敏化的多种治疗方式相组合的智能治疗策略,台湾清华大学Hsin-Cheng Chiu等人开发了一种新的纳米光疗系统。1)此纳米治疗药物由聚硫代丙二酸二乙酯(PSDEM)和PEG-PSDEM-PEG组装而成,以琥珀酰苯胺异羟肟酸(SAHA)为RT敏化剂,吲哚菁绿(ICG)为光热/光动力学剂,在近红外线照射和X射线放射治疗下表现出结构变化和释放治疗有效载荷的能力。2)随着肿瘤部位发生了高度局部性和可控性的反应,活性氧(ROS)引发的SAHA卸载和热疗诱导的氧气的血管通透性导致靶组织在RT中显著增敏,进而与光动力/光热疗法(PDT/PTT)相结合,提高了治疗效果。3)体外研究表明,用ROS诱导的致敏RT处理4T1乳腺癌细胞后,细胞内DNA双链受到损伤,细胞增殖受到抑制。同时,由于光介导的治疗与致敏的RT的联合作用,与单独使用RT的效果相比,细胞存活率也显著降低。4)将PDT/PTT纳米光疗技术与ROS诱导的低剂量(6 Gy)致敏RT联合应用,6只4T1乳腺癌小鼠中有5只小鼠的原发肿瘤被完全根除并抑制了肺转移,60天内存活率高达83%。Te-I.Liu, et al. New combination treatment from ROS-Induced sensitized radiotherapy with nanophototherapeutics to fully eradicate orthotopic breast cancer and inhibit metastasis. Biomaterials, 2020.DOI: https://doi.org/10.1016/j.biomaterials.2020.120229https://doi.org/10.1016/j.biomaterials.2020.1202294. ACS Nano:刺激响应性纳米放射增敏剂—增强肿瘤渗透性和放疗敏感性

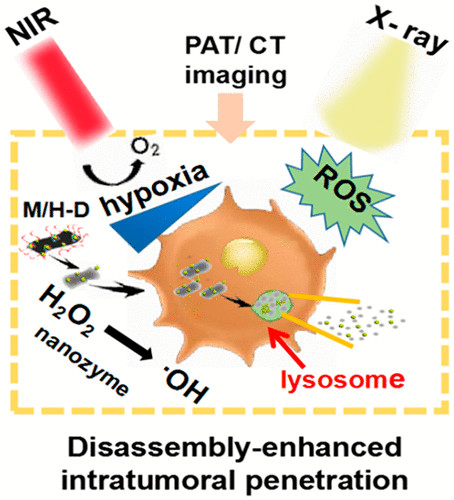
开发一种有效的纳米放射增敏系统,在保留正常组织的同时,提高癌细胞的辐射剂量,使放射治疗(RT)变得敏感,是一种非常理想的方法。在此,中国科学院高能物理研究所谷战军、尹文艳、首都师范大学王强等人构建了一种肿瘤微环境(TME)响应性可拆卸二硫化钼/二氧化铪(MoS2/HfO2) 葡聚糖(M/H-D)纳米放射增敏剂。1)M/H-D可以降解并释放TME中的HfO2纳米粒子,以增强HfO2纳米粒子在近红外照射下对肿瘤的穿透能力,从而解决了HfO2纳米粒子内化不足的瓶颈。2)近红外光热疗法提高了TME中M/H-D纳米辐射增敏剂的类过氧化物酶催化效率,其可以选择性地催化肿瘤内过表达的H2O2使其转化为高度氧化的羟基自由基(·OH)。因此,这种对TME敏感的精准纳米放射增敏作用提高了辐射效率,有效增强了肿瘤的氧合作用,同时实现了肿瘤的有效抑制,此外,还可结合计算机断层扫描和光声成像进行实时监测。Wenhui Fu, et al. Stimuli-Responsive Small-on-Large Nanoradiosensitizer for Enhanced Tumor Penetration and Radiotherapy Sensitization. ACS Nano, 2020.DOI: 10.1021/acsnano.0c03094https://doi.org/10.1021/acsnano.0c03094