
•成功合成了射频响应性双价金纳米簇多功能血管栓塞剂(dvGC@PNAs),用于实体瘤的综合介入治疗。
•具有高含量的Au(I)离子,其Au(I)离子包绕Au(0)的核壳型纳米结构dvGC@PNAs表现出独特的RF诱导的加热效果。
•dvGC@PNAs极大地改善了TAE手术后的肿瘤缺氧免疫微环境,诱导了良好的免疫效应,增强了RFA和TAE的抗肿瘤协同作用。
血管栓塞术(TAE)在肝癌临床治疗上发挥着重要作用。然而由于肝癌血管系统的高度异质性,TAE对于肝癌乏血供区域治疗效果不佳。射频消融(RFA)对于乏血供肿瘤组织具有良好的治疗效果,但在血流丰富的肿瘤区域,由于血流的散热作用,RFA消融温度迅速降到50 oC以下,导致“热沉积”效率降低。TACE和RFA联合应用可在一定程度上提高肿瘤组织的“热沉积效应”,改善肿瘤的热分布。然而,如何高效协同TAE与RFA的治疗效果,在肝癌综合介入治疗中仍是一个巨大的挑战。有鉴于此,华中科技大学国家纳米工程中心杨祥良/赵彦兵课题组成功制备了具有射频响应的多功能纳米血管栓塞剂dvGC@PNAs,并与协和医院郑传胜团队合作,对其TAE-RFA联合肝癌介入治疗的疗效及其协同机制进行了评价。
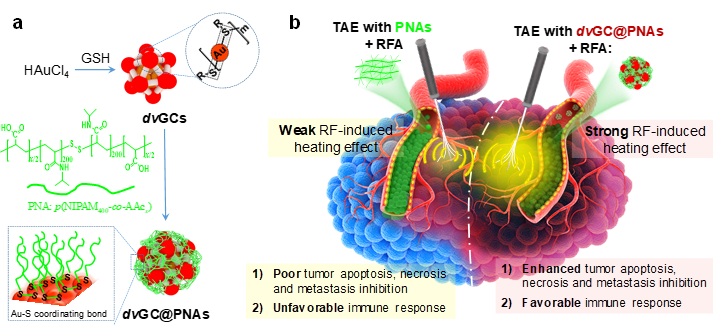
示意图
1)成功制备了具有射频响应的多功能纳米血管栓塞剂dvGC@PNAs,并对其组成结构进行了表征。
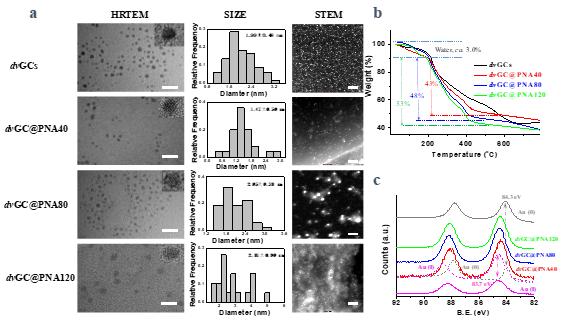
材料物化表征
2)通过温敏溶胶-凝胶相变特性,dvGC@PNAs兼具超液化的导管通过性和“铸型”性的逐级血管栓塞性,很好地解决了血管栓塞剂面临的“流动-栓塞困境”。并通过射频响应特性改善富血供肿瘤区域的热沉积效率与分布,提高了TAE/TACE与RFA的协同抗肿瘤效果。
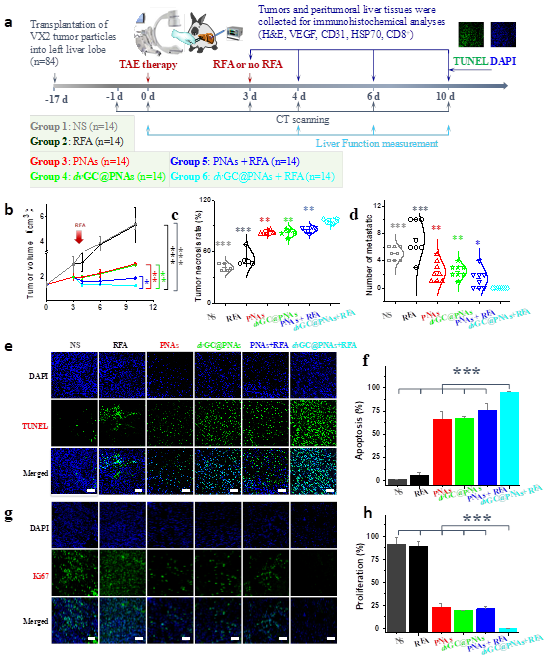
体内抗肿瘤
3)dvGC@PNAs可显著改善栓塞术后的缺氧微环境,激发特异性肿瘤免疫反应,杀灭残存肝癌细胞,有效地抑制了肝癌的复发与转移。
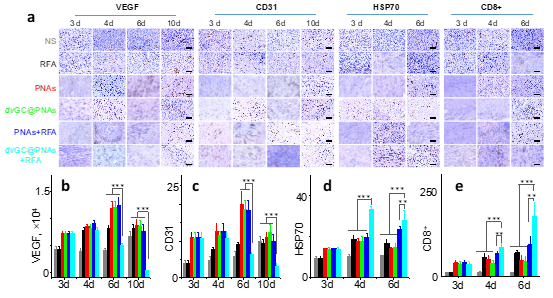
免疫组织化学评价
综上所述,射频响应的dvGC@PNAs血管栓塞剂兼具良好的流动性和栓塞性,并有效改善富血供肿瘤区域的热沉积效率与分布,缓解栓塞术后缺氧程度,并激发特异性肿瘤免疫反应,从而高效协同TAE-RFA联合抗肿瘤效果,为发展新型多功能血管栓塞材料提供了有益的思路和策略。Ling Li, Xiaopeng Guo, Xiaole Peng, HongsenZhang, Yiming Liu, Han Li, Xiaojun He, Dingwen Shi, Bin Xiong, YanbingZhao, Chuansheng Zheng, Xiangliang Yang, Nano Today, 2020.DOI:10.1016/j.nantod.2020.100934https://doi.org/10.1016/j.nantod.2020.100934










