

第一作者:Michael M. Yamano, Andrew V. Kelleghan, Qianzhen Shao(共同一作)
通讯作者:K. N. Houk, Neil K. Garg
通讯单位:加州大学洛杉矶分校
研究亮点:
1.对高能量环状结构联烯中间体的反应控制。
2.Ni基非贵金属手性催化。
3.扩展了联烯中间体的反应类型。
研究背景
在有机化学反应中,反应位点、产物立体构型都需要设计和控制。特别是在反应中间体物种的能量较高时,反应产物立体构型的控制就更有挑战性。芳烃,环状炔烃和环状烯等高应力环状有机分子受到化学家的广泛关注,这种环结构中具有高应力(30~50 kcal/mol),因此此类瞬态中间体物种在包括环加成、亲核捕获等多种反应中展现出非常高的反应活性,并且能得到结构复杂产物。
近日,有机合成大师Houk等在Nature上报道了通过环状邻位SiEt3修饰的烯烃作为反应物,在Ni催化体系中实现了对烯烃的高张力环状联烯中间体在邻位进行环化。进一步的,通过调控手性配体环境、反应速率等实现了手性合成。
拟解决或者拟探索的关键问题
探索高能量联烯中间体物种的手性成环反应。
成果简介
虽然目前在此类反应中,控制反应的绝对立体结构能够通过化学计量比的手性试剂进行控制,但是催化量不对称合成仍未见相关报道。有鉴于此,加州大学洛杉矶分校K. N. Houk、Neil K. Garg等报道了通过瞬态环状联烯中间体实现了对手性反应产物中手性绝对构型的控制。
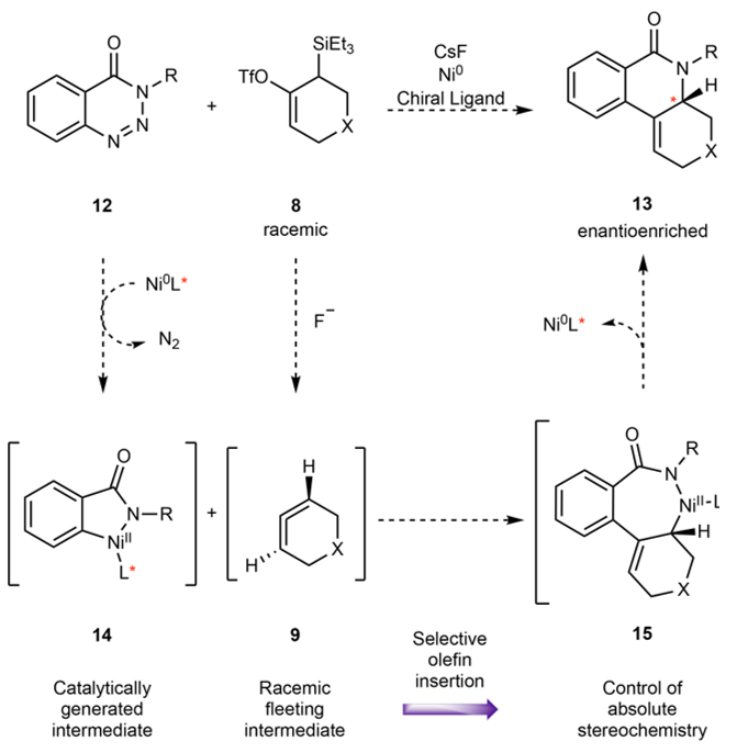
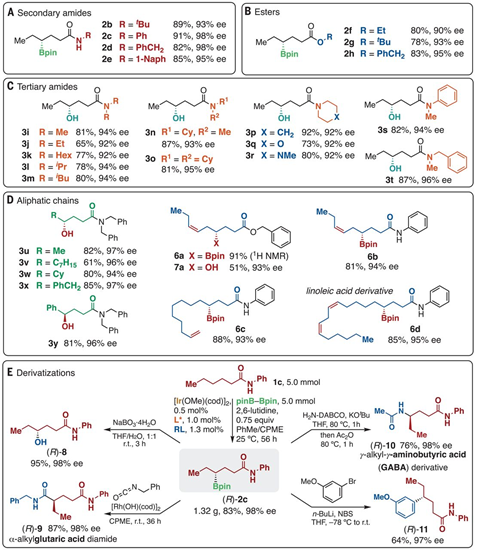
图1. 前期背景:化学计量比Ni催化联烯的手性反应。
要点1:反应优化
通过1倍量苯并三嗪酮(16)、1倍量三乙基硅烷/OTf基烯烃作为联烯前分子(17),在5 mol % Ni(cod)2/10 mol % dppf 作为Ni催化体系,加入2.5倍量CsF诱导原位生成联烯,在35 ℃ MeCN中进行反应。通过该过程,实现了消除OTf、SiEt3生成联烯中间体和苯并三嗪酮进行非手性进行成环反应。该反应中的苯并三嗪酮的N上兼容甲苯基(tolyl),对氟苯基(fluorophenyl),甲基等官能团、并且兼容可消除的苄基位点。苯环结构上对缺电子羰基修饰、富电子甲氧基修饰同样具有兼容性,吗啉、噻吩等杂环芳烃同样对该物种兼容。该方法能实现合成具有抗癌作用的石蒜科生物碱菲啶酮类分子。
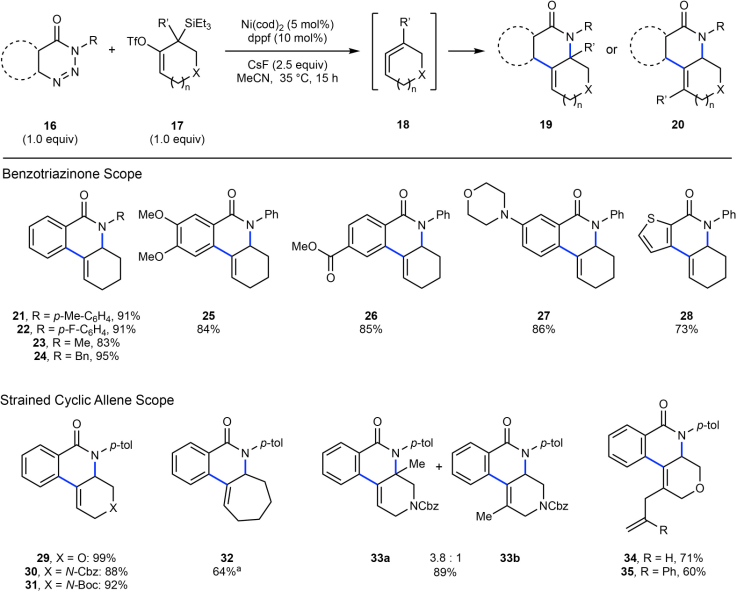
图2. 反应和底物拓展。
要点2:手性反应
作者发现三氟甲硅烷基修饰的前联烯分子在暴露氟化物(F-)后,会转化为两种不同手性结构的联烯混合物,并且这两种手性结构的联烯会发生快速转变。但是,通过动力学拆分(DKR),能够得到对映体富集的手性产物。
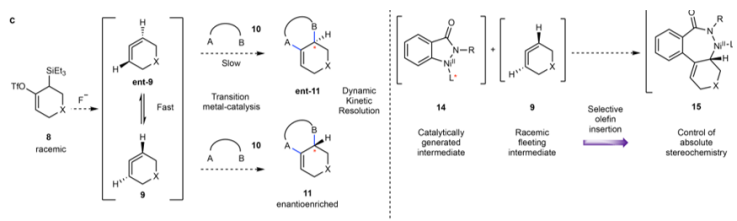
图3. 手性反应设计Scheme。
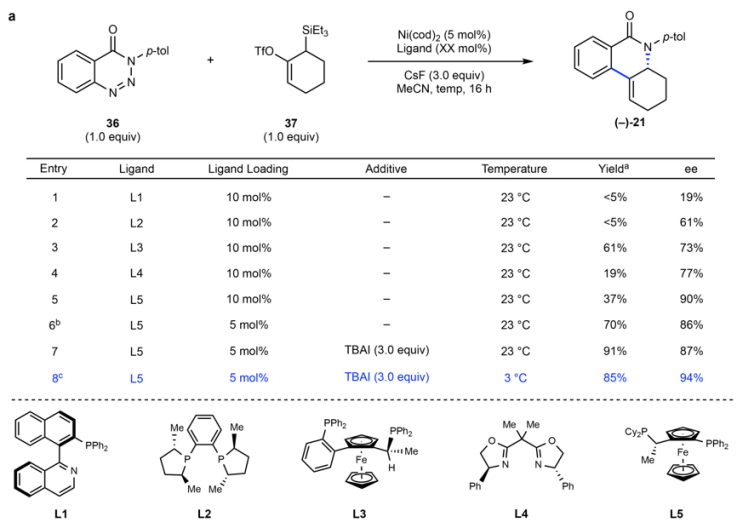
图4. Ni催化手性联烯成环反应。
作者在反应中加入手性配体分子,考察36和8的手性成环反应。在加入Quinap(L1)后(以往常用于联烯的手性转化),反应的手性选择性非常低(Entry 1);在加入DuPhos(L2)后,手性选择性达到61 % ee(Entry 2);Josiphos(L5)展现了高达90 % ee的手性选择性,但是产物的产率仅为37 %(Entry 5),但是当将配体的量降低至5 mol %,产率增加为70 %。作者认为配体导致产物的分解导致;当在反应中加入3倍量四丁基碘化铵(TBAI)提高氟化物的溶解性,进而促进联烯的合成速率,并降低反应温度至3 ℃并通过在24 h反应,实现了以85 %的产率和94 % ee进行反应(Entry 8)。
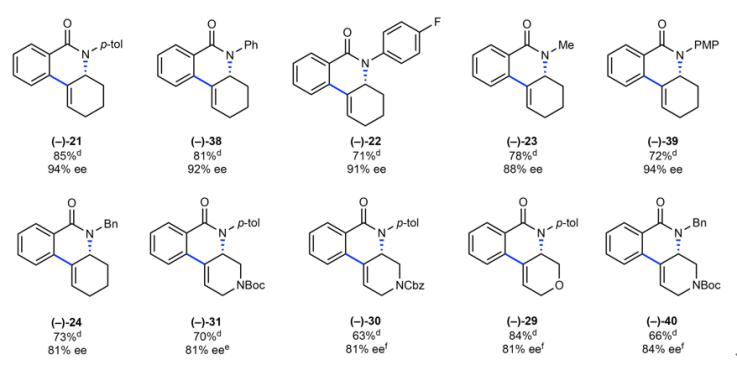
图5. 联烯成环反应底物拓展。
要点3:反应机理
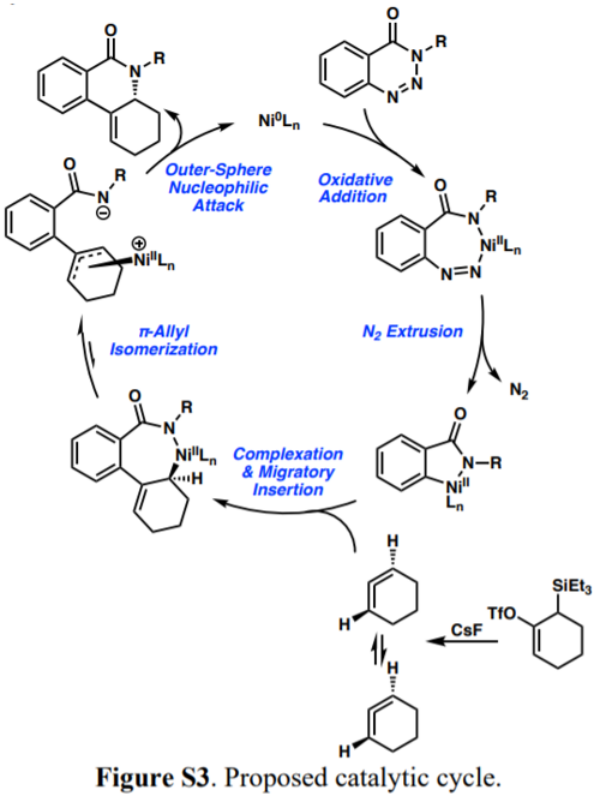
图6. 反应机理。
通过DFT计算模拟对反应机理过程研究,作者认为该手性构建过程经过3个步骤:
1. 在立体选择烯烃插入过程中进行对环状联烯对映体的动力学拆分
2. 形成外消旋的η3-烯丙基镍中间体物种
3. 经由外球过程对C1位点立体选择性反应。
并由此提出了可能性较高的Ni催化反应机理。Ni0Ln对苯并三嗪酮进行氧化加成,得到NiII金属7元环中间体物种,随后通过消除1分子N2,得到NiII金属5元环状内酰胺中间体。通过对环状联烯中间体进行插入得到NiII金属7元环内酰胺中间体。进一步的通过中间体开环,异构化形成η3-烯丙基镍、随后在外球亲核进攻作用中得到烯烃邻位手性化产物。
参考文献
Michael M. Yamano, et al. Intercepting fleeting cyclic allenes with asymmetric nickel catalysis, Nature 2020
DOI: 10.1038/s41586-020-2701-2
https://www.nature.com/articles/s41586-020-2701-2











