奇物论联合纳米人编辑部对2020年国内外重要科研团队的代表性成果进行了梳理,今天,我们要介绍的是ACS Nano的副主编、加拿大多伦多大学生物材料与生物医学工程学院(IBBME)Warren C. W. Chan教授课题组

Warren Chan教授课题组目前致力于研究和理解纳米材料与生物系统和生物分子传感的相互作用。旨在通过工程化新型纳米材料(例如无机和聚合物纳米结构)以及开发微技术(例如微机电系统和毛细管流动系统)来解决生物学问题。目前已在Science、Nature Materials、Nature Nanotechnology、Nature Reviews Materials、JACS上发表上百篇论文。
一、纳米医学
1. Nature Materials:挑战传统,纳米颗粒进入实体瘤新机制

加拿大多伦多大学Warren C. W. Chan等人探讨了纳米颗粒肿瘤渗透的现象,并质疑了纳米颗粒进入实体瘤的机制。 该课题组发现内皮间隙并不是纳米颗粒进入实体肿瘤的原因。取而代之的是,发现多达97%的纳米颗粒是通过内皮细胞的主动过程进入肿瘤的。
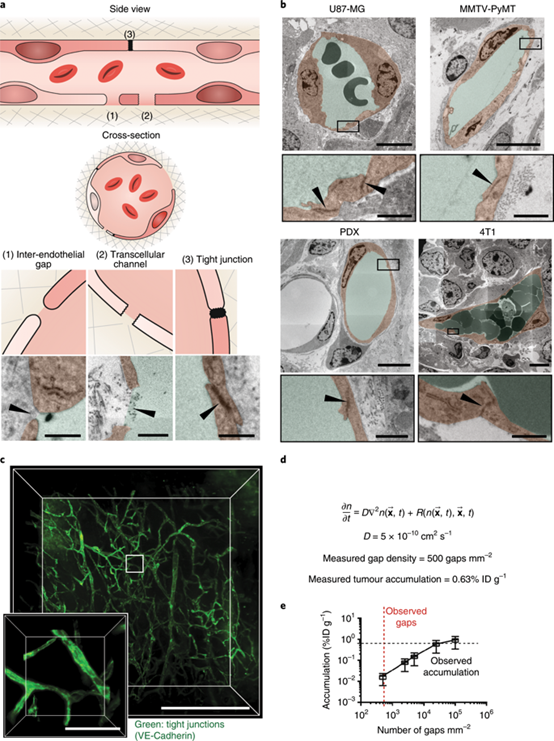
Sindhwani, S., Syed, A.M., Ngai, J. et al. The entry of nanoparticles into solid tumours. Nat. Mater. (2020)
doi:10.1038/s41563-019-0566-2
https://doi.org/10.1038/s41563-019-0566-2
2. Nature Materials,直接调节剂量即可提高肿瘤递送效率!

加拿大多伦多大学Warren C. W. Chan等人发现给药剂量的阈值是解决递送效率低的关键,想要实现可预测和显著的释放,则必须打破这个剂量阈值。实验结果证实了单次注射超过1万亿个纳米颗粒的阈值可以改善肿瘤的递送。而且还表明,对于各种纳米颗粒的大小、组成和肿瘤模型,超过1万亿个纳米颗粒的剂量都会显着增加了肿瘤的递送。
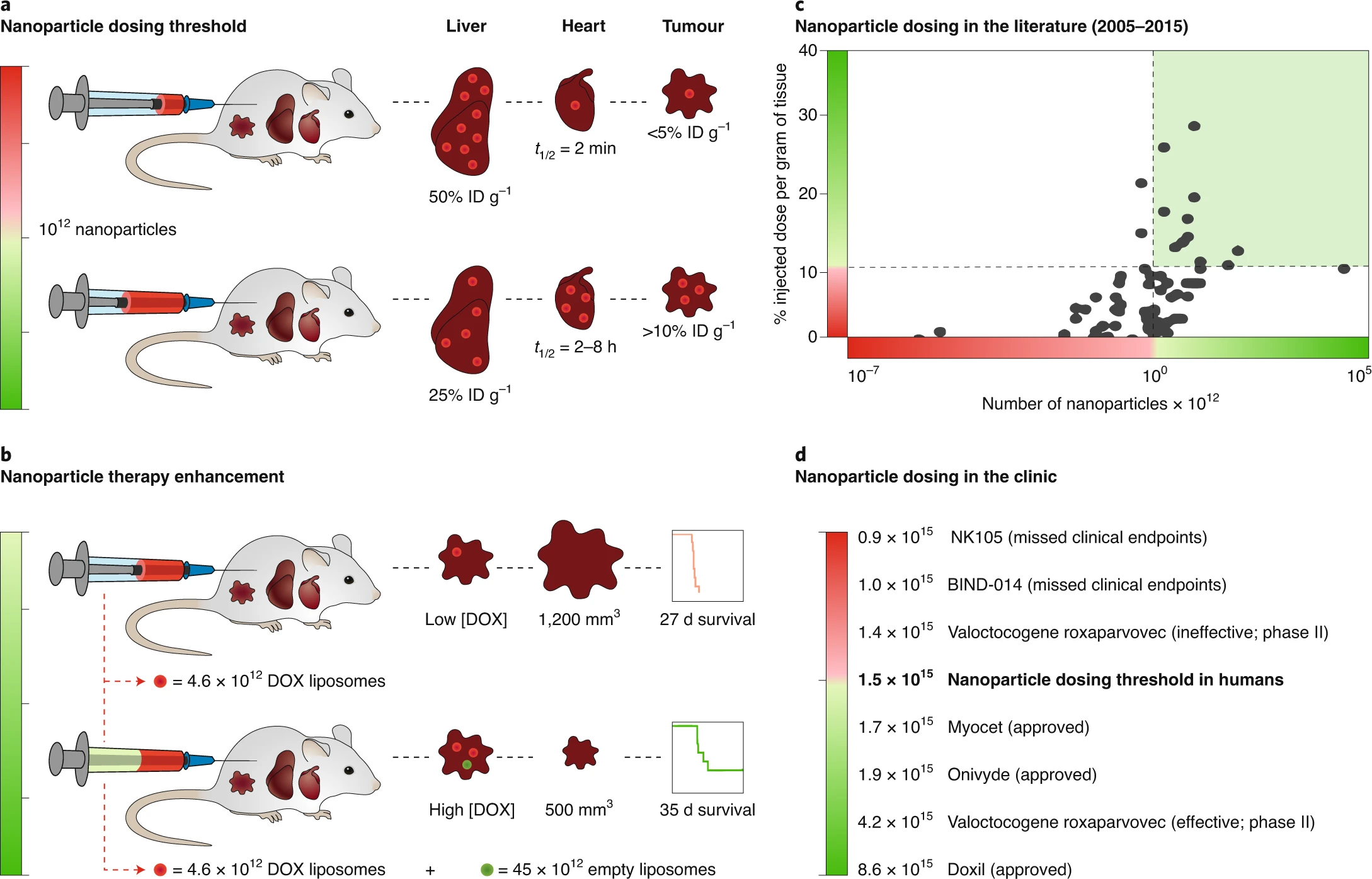
Ouyang,B., et al. The dose threshold for nanoparticle tumourdelivery. Nat. Mater. (2020).
https://doi.org/10.1038/s41563-020-0755-z
3. Nature Nanotech.:设计递送系统的未来框架

当前的设计范式主要是从物理(即化学和材料特性)入手,而不是从生物学的角度出发。因为纳米颗粒与器官组织相互作用时,这就会导致纳米颗粒滞留在非靶向的器官组织,而到达疾病部位的剂量则相对减少,以致制剂的功效降低。
鉴于此,加拿大多伦多大学Warren C. W. Chan等人于Nature Nanotechnology期刊上发表重要综述,讨论了生物学的作用和它的障碍,以指导纳米颗粒设计递送药物到目标位置。他们建议开发一个框架,以构建使用纳米粒子-生物相互作用数据和计算分析来指导未来纳米材料设计和传输策略的最佳传输系统。

Poon,W., Kingston, B.R., Ouyang, B. et al. A framework for designing delivery systems. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-020-0759-5
4. AM: 流速会不会影响纳米摄取?

纳米颗粒通常通过全身注射来给药,这使得它们暴露于血流的动态环境中。注射的纳米颗粒在血液中以各种流速传播,这些流速会引起不同的血管剪切速率。内皮细胞在这些血管中排列,在循环过程中摄取纳米颗粒,但是这种相互作用在体内的流量依赖性却很难表征。
有鉴于此,加拿大多伦多大学陈志和(Warren C. W. Chan)教授课题组开发了一种微流控系统来控制纳米颗粒与内皮细胞相互作用时的流速,探索流速对“纳米粒子-细胞”相互作用的影响。
流速与细胞摄取成反比
研究人员将纳米金颗粒在内皮细胞中的摄取以不同的流速进行定量,发现流速的增加会导致纳米颗粒的摄取减少。内皮细胞对增加的流量剪切速率响应,使得吸收纳米颗粒的能力降低。该平台能够显示流速对细胞与纳米颗粒之间相互作用的影响:流速与细胞摄取之间存在反比关系。
靶向化是否有影响?
研究人员还发现,使用靶向剂结合内皮细胞可以减轻血流速度的某些影响。用内皮细胞结合配体修饰纳米颗粒表面可以将吸收部分地恢复到非流动水平,这表明功能化纳米颗粒结合内皮细胞可以使纳米颗粒抵抗流动效应。
综上,该项工作是第一代旨在探索流速对“纳米粒子-细胞”相互作用影响的微流控系统,设计简单。但体内的血管情况更为复杂,未来的微流体系统将需要包括更复杂的微流控结构来模仿这种曲折的脉管系统,需要开发这样的装置来对纳米颗粒与生物系统之间的相互作用进行基础研究。这些研究对于设计用于医疗应用的纳米材料至关重要。

Yih Yang Chen et al. Flow Rate Affects Nanoparticle Uptake into Endothelial Cells. Adv. Mater. 2020.
https://doi.org/10.1002/adma.201906274
5. JACS: 分析纳米蛋白冠的结合功能和结构组织

静脉注射后,血液蛋白质吸附到纳米颗粒的表面上,形成蛋白冠(protein corona)。尽管在过去30年中对蛋白冠进行了大量研究,但只有少数研究了血清吸附蛋白的结构和结合功能。此外,蛋白质是否可以与其靶受体结合仍不清楚。这会影响蛋白冠如何介导细胞与组织的相互作用。于此,加拿大多伦多大学Warren C. W. Chan等人使用免疫测定方法研究了蛋白冠的功能和结构组织。
本文要点:
1)研究发现,只有27%的吸附蛋白可以与目标蛋白结合。这是因为蛋白冠结构不是单层的,而是彼此结合的蛋白质的组装体。
2)研究进一步证明了可以通过改变装配体中蛋白质的组织来控制蛋白质的结合功能。表明操纵蛋白冠蛋白成分和组装可以影响它们与培养中的巨噬细胞的相互作用。
这项研究为纳米材料上的蛋白冠提供了详细的功能和结构见解,并提供了一种新的策略来操纵它以控制与生物系统的相互作用。

Yuwei Zhang, et al. An Analysis of the Binding Function and Structural Organization of the Protein Corona. Journal of the American Chemical Society 2020.
DOI: 10.1021/jacs.0c01853
https://pubs.acs.org/doi/10.1021/jacs.0c01853
6. ACS Nano:抑制被膜下窦巨噬细胞可增强纳米疫苗向淋巴结滤泡的转运

纳米疫苗需要被运送到淋巴结滤泡,以诱导体液免疫并产生中和抗体。在此,加拿大多伦多大学Warren C.W. Chan等人发现被膜下窦巨噬细胞在阻止纳米疫苗进入淋巴结滤泡方面起到了屏障作用。这通过在纳米疫苗运输过程中移除或功能性改变这些细胞后测量体液免疫反应来说明。
本文要点:
1)在抑制被膜下窦巨噬细胞后,获得了高达60倍的抗原特异性抗体产生。抗体产生增强的程度取决于纳米疫苗的剂量和大小、配方和给药时间。
2)进一步发现,破坏巨噬细胞摄取功能的药理制剂可以被认为是疫苗开发中的佐剂。与单独使用纳米疫苗相比,使用这些制剂配制的纳米疫苗免疫小鼠可以诱导30多倍的抗原特异性抗体产生。
这些发现表明,改变运输障碍,使更多的纳米疫苗能够输送到淋巴结滤泡,以产生中和抗体,是促进疫苗接种的有效策略。

Yi-Nan Zhang, et al. Suppressing Subcapsular Sinus Macrophages Enhances Transport of Nanovaccines to Lymph Node Follicles for Robust Humoral Immunity, ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02240
https://doi.org/10.1021/acsnano.0c02240
二、追踪纳米递送
7. PNAS:使用3D显微镜和机器学习评估微转移作为纳米粒子的靶标

成功地向转移性肿瘤输送治疗药物对于控制肿瘤生长和提高癌症患者生存率至关重要。由于目前用于分析药物载体与转移性肿瘤相互作用的技术的局限性,设计靶向转移性的药物载体具有挑战性。加拿大多伦多大学Warren C. W. Chan等人通过开发一个新的成像和图像分析工作流程来克服这个问题,该工作流程使能够跟踪纳米颗粒在微转移肿瘤中的传递、渗透和分布。
更重要的是,可以利用机器学习算法,根据纳米颗粒的生理特性,预测纳米颗粒向微转移肿瘤的递送。这使能够预测可以更有效地靶向的微转移病理生理。
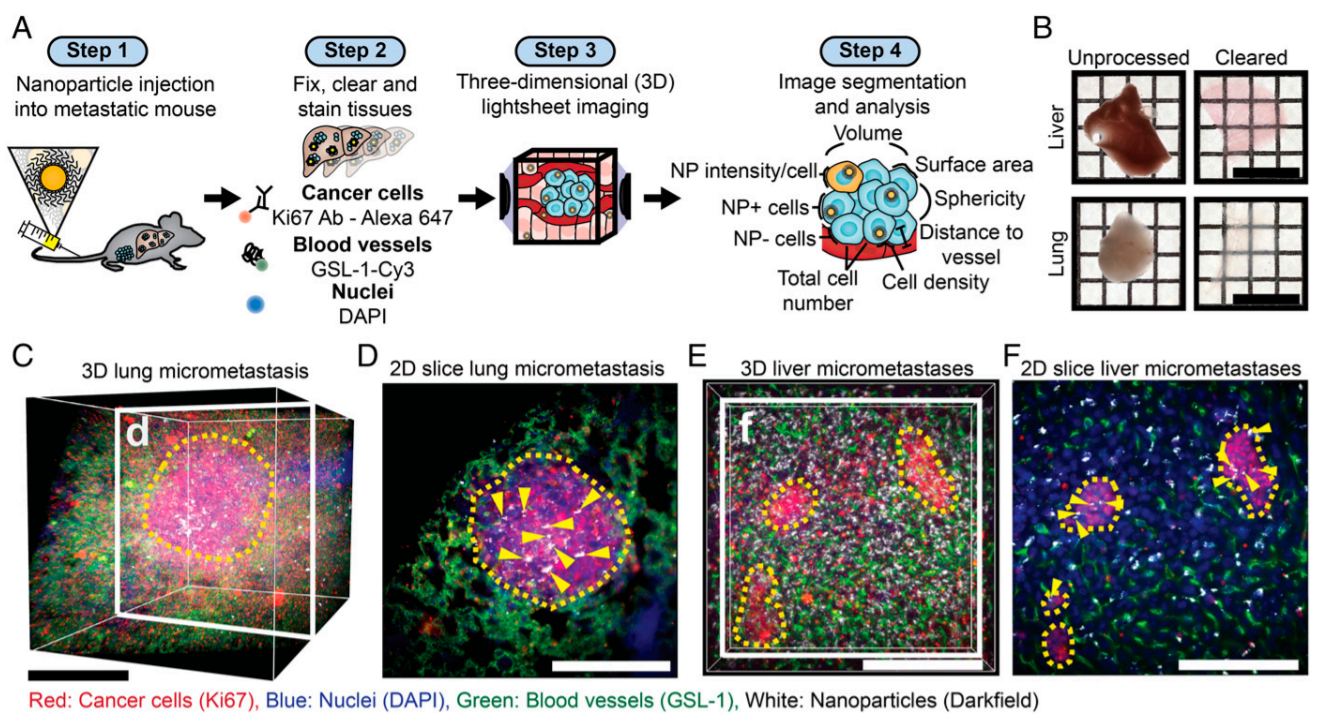
Benjamin R. Kingston, et al., Assessing micrometastases as a target for nanoparticles using 3D microscopy and machine learning. PNAS 2019 116 (30) 14937-14946
https://doi.org/10.1073/pnas.1907646116
8. Nano Letters:在光学透明组织中对脂质体成像

三维(3D)光学显微镜可用于理解和改善纳米药物的输送。然而,这种方法不能用于分析组织中的脂质体,因为使组织透明成像的处理步骤通常会把脂质给除掉。于此,加拿大多伦多大学Warren C. W. Chan等人开发了一个称为REMNANT的标签,该标签可对生物组织中的有机材料进行3D成像。
研究人员证明了此标签可用于完整组织中脂质体的3D定位成像。还表明,该标签能够监控包裹的治疗剂的释放。还发现脂质体的货物在体内组织中释放比常规体外试验快100倍以上。这使得能够设计出一种脂质体制剂,它具有更强的杀伤肿瘤相关巨噬细胞的能力。该发展为研究在完整的生物环境中施用的有机材料的化学性质和药效学提供了新的机会。这种方法可洞察可降解材料的体内行为,其中新发现的信息可指导下一代成像和治疗剂的工程设计。

Abdullah Muhammad Syed, et al., Liposome Imaging in Optically Cleared Tissues. Nano Letters 2020 20 (2), 1362-1369
DOI: 10.1021/acs.nanolett.9b04853
三、技术优化
9. JACS: DNA控制小分子在蛋白质中的封装

纳米颗粒可以容纳多种类型的治疗剂和成像剂,用于疾病的治疗和诊断。然而,控制分子在纳米颗粒中的存储是具有挑战性的,因为用于封装是利用非特异性分子间的相互作用。于此,加拿大多伦多大学Warren C. W. Chan等人使用特定的DNA相互作用将分子存储在纳米颗粒中。
本文要点:
1)研究人员制备了包含DNA锚的纳米颗粒,以捕获与DNA结合的小分子。通过改变DNA锚的序列和化学计量,研究人员可以控制纳米粒子中具有不同化学性质的分子的数量和比例。
2)还通过改变包封药物(美坦星和阿霉素)的比例来改变纳米颗粒对癌细胞的细胞毒性。专门控制多种类型分子的存储能够优化组合药物和纳米颗粒成像的性能。
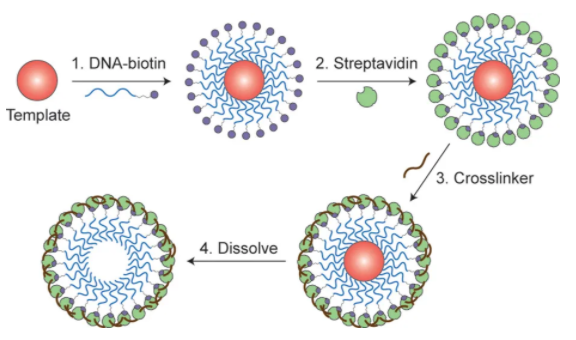
Wayne Ngo, et al., DNA-Controlled Encapsulation of Small Molecules in Protein Nanoparticles. Journal of the American Chemical Society 2020.
DOI: 10.1021/jacs.0c09914
https://pubs.acs.org/doi/10.1021/jacs.0c09914
10. PNAS: 可调节和精确的微型锂加热器,适用于床旁护理应用

从诊断疾病到生产疫苗,各种不同的床旁护理应用都需要生化技术。这些应用中的许多应用由于依赖电力进行温度控制而无法在偏远地区使用。于此,加拿大多伦多大学Warren C. W. Chan等人开发了一种微型锂加热器,其尺寸比现有技术小8,000倍,从而可以在床旁护理时使用生化技术。该设备可以在1分钟的上升时间内提供从37°C到65°C的可调的加热和在5°C以内的精确温度。
通过在检测病毒存在的模型工作流中使用这些加热器,研究人员证明了它们对需要精确温度控制的广泛生化技术的适用性。这项技术可广泛用于诊断和治疗应用,例如在救灾营地或登山探险中。
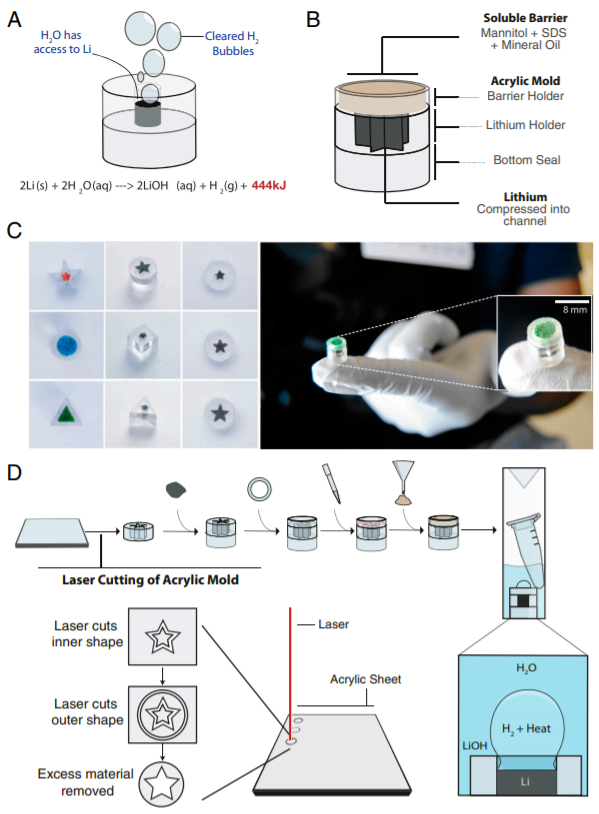
Buddhisha Udugama, et al., Tunable and precise miniature lithium heater for point-of-care applications. PNAS 2020 117 (9) 4632-4641
https://doi.org/10.1073/pnas.1916562117
11. ACS Nano:诊断COVID-19:疾病和检测工具

最初,主要使用计算机断层成像、全基因组测序和电子显微镜的结合用于筛选和鉴定SARS-CoV-2。加拿大多伦多大学Warren C. W. Chan等人在该综述种旨在向读者介绍SARS-CoV-2的诊断和监测技术及其性能特点。并描述了即将出现的床旁护理诊断,并鼓励学术界将他们的技术超越概念。开发即插即用诊断技术来管理SARS-CoV-2疫情,将有助于预防未来的流行病。

Buddhisha Udugama, et al., Diagnosing COVID-19: The Disease and Tools for Detection. ACS Nano 2020 14 (4), 3822-3835
DOI: 10.1021/acsnano.0c02624

个人简介:

Warren C. W. Chan,于2002年加入多伦多大学生物材料与生物医学工程学院(IBBME),并于2008年晋升为副教授,并于2012年晋升为正教授。他的课题组正在开发用于诊断和治疗癌症和传染病的纳米技术。
他曾获得Kabiller国际纳米医学奖(2015),NSERC E.W. Steacie奖学金(2012),以及2006-2016年加拿大Bionanoengineering研究主席。他之前曾担任IBBME的协作计划总监(2008-2011),目前是ACS Nano的副主编。











