
第一作者:李苏昕 博士
通讯作者:高金明 教授
通讯单位:美国德克萨斯大学西南医学中心
具有pH响应功能的材料可以通过感知机体微环境作出响应,作为诊断试剂或治疗药物的递送载体而备受关注,然而材料自身的生物学性质往往被忽略。最近德克萨斯大学西南医学中心高金明教授课题组另辟蹊径,报道了一种具有pH超敏性能的的高分子聚合物免疫激动剂,能够响应微酸性环境进入免疫细胞的细胞质中,通过与细胞内的STING蛋白多价结合发生相转变过程,促使STING形成胶连体(biomolecular condensate),从而更高效地招募并激活下游蛋白,并表现出异于小分子激动剂的临床适用范围及长效免疫活化作用。相关成果发表在Nature Biomedical Engineering上,题为“Prolonged activation of innate immune pathways by a polyvalent STING agonist”。
背景介绍:
STING得名于干扰素基因刺激蛋白(Stimulator of interferon genes),在近年来已成为免疫治疗的明星靶点,广泛应用于治疗感染性疾病与恶性肿瘤的研究中。STING是生物体天然免疫系统的核心组成成分,表达于各类细胞中,通过上游cGAS通路识别细胞质中的双链DNA作为危险信号被激活,进而促进I型干扰素(IFN-I)的分泌以及多种促炎症因子与趋化因子的产生,并通过一系列级联反应,诱导适应性免疫系统的激活,最终促进效应T细胞的增殖与活化。制药公司对以STING为靶点的药物开发表现出了罕见的热情,近五年来Aduro/诺华, 默沙东, 默克,葛兰素史克等公司先后研制出以STING为靶点的小分子激动剂进入临床一期用于单一或联合治疗实体瘤与淋巴瘤,然而早期的临床数据表明令人失望,患者的响应率并不高。小分子药物在体内的代谢快、对肿瘤的选择性差成为制约其在临床安全有效应用的主要屏障。如何设计出能够高效靶向细胞质中分布的STING蛋白的新型激动剂成为研究的最新热点。
高金明团队早期通过将肿瘤特异性抗原片段包载在pH超敏性聚合物胶束(Ultra-pH-sensitive NPs, UPS)中构建了一种新型抗肿瘤纳米疫苗,该制剂在多种荷瘤小鼠模型中表现出良好的抑制肿瘤生长的能力。UPS可以通过内吞体逃逸机制帮助肿瘤抗原在抗原呈递细胞的细胞质中释放并呈递给MHC-I类分子,从而诱导CD8+ T细胞的活化与对肿瘤细胞的杀伤。有趣的是,研究人员发现当使用一种自组合成的名为PC7A的UPS聚合物胶束递送抗原的同时,其也能在一定程度上发挥免疫佐剂的功效,然而当时并不清楚具体免疫激活的机理。在最新的研究中,作者采用分子生物学手段对PC7A激活STING信号通路进行了深入的机制分析,并以此为基础设计构建了新一代STING高分子激动剂,在多种动物模型及临床病人组织样本上验证了所得药剂的免疫刺激功能和肿瘤治疗的潜力。
研究亮点:
1.首次报道了人工合成的高分子STING激动剂,与小分子激动剂相比具有不同的结合模式与生物特征,为新一代临床可用的STING激动剂的设计提供了新的思路。
2.高分子激动剂与STING蛋白通过多价结合相互作用并发生相转变形成胶连体,更加高效地激活下游免疫信号通路。
3.将高分子STING激动剂与小分子激动剂(cGAMP)联合制备成新的纳米制剂(cGAMP-PC7A NPs),以治疗不同临床亚型的个体,并且表现出迅速而持久的免疫应答反应。
要点1:高分子纳米粒的pH响应型,高效“靶向”免疫细胞细胞质中的STING蛋白
STING蛋白表达于细胞质中的内质网上,一般的小分子药物很难通过细胞膜屏障进入细胞内部与STING发生相互作用,同时其容易被组织中大量存在的酶水解而失活,因此临床中疗效欠佳。高分子PC7A在进入体内后以纳米胶束形式稳定存在,一旦被细胞捕获内吞,胶束粒子进入早期内吞体并响应酸性环境解离成为单链形式,并释放至细胞质中,与STING蛋白发生相互作用。
等温量热滴定法结果表明,具有侧链为环形叔胺的高分子聚合物PC7A比侧链为线形叔胺的聚合物PEPA表现出更强的STING结合能力(72nM vs 671nM),细胞实验也证实PC7A具有更强的激活STING信号通路产生效应分子I型干扰素的能力(图1)。
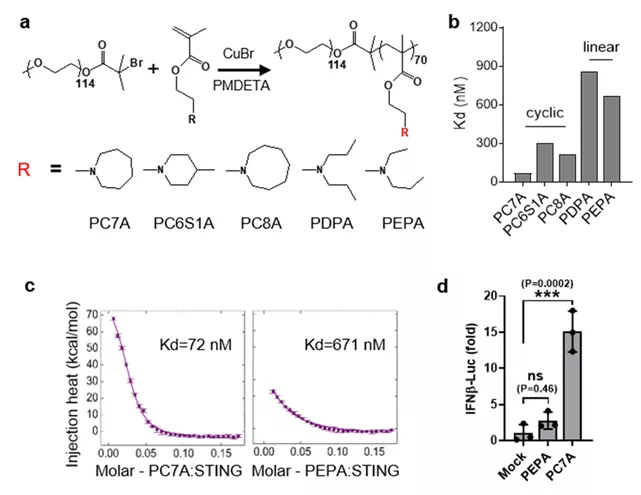
图1. PC7A高分子聚合物对STING蛋白具有较强的结合与激活能力
要点2:PC7A以异于小分子激动剂的结合模式与STING作用,表现出针对多种临床亚型的响应行为及持久的免疫活化能力
通过计算机模拟与定点氨基酸突变技术,作者揭示了PC7A与STING的结合发生在PC7A的支链含氮七元环与STING二聚体侧面的E296-D297序列区域(图2a)。由于PC7A聚合物含有数十个重复结构单元,同时STING二聚体可以提供两个结合位点,二者发生多价结合发生形成复合胶连结构(图2b)。STING蛋白在此胶连体中局部浓度富集并以寡聚体形式存在,有利于对下游蛋白TBK1与IRF3的招募与磷酸化。在显微镜下可以观察到由STING与PC7A组成的微米级别的胶连体的形成以及其与p-TBK1的共定位(图2c)。这种STING蛋白由游离相变为胶连体的过程称之为“相转变”。相转变的发生成浓度依赖性,当增加STING蛋白或PC7A的浓度时,将会形成数量更多的胶连体(图2d)。同时研究表明,相转变的程度,生物效应的产生,与PC7A重复单元的数目(即价位)直接相关。若使用低重复单元(如20)的聚合物,则胶连程度很低,STING激活能力较差;若使用很高重复单元(如110)的聚合物,虽然胶连大量发生,但生物效应却不甚强,可能与STING功能的饱和以及结合模式的不可逆有关;当选择适中的重复单元(如70)的聚合物时,生物效应达到最高值(图2e)。
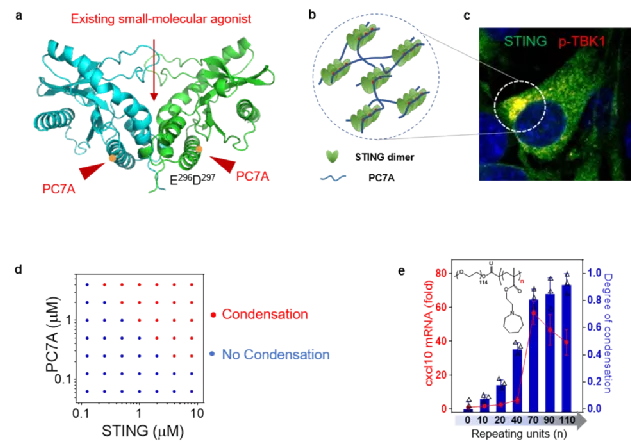
图2. PC7A通过多价结合的相转变过程激活STING
有趣的是,由于与STING的作用模式不同以及独特的pH响应介导的胞内内吞体逃逸行为,聚合物纳米粒较小分子激动剂(如cGAMP)表现出缓慢而持久的免疫激活能力:起效时间为12h之后,并在48h时仍可检测到IFN-I的产生(图3a,b)。同时,STING蛋白有许多亚型表达,如232号氨基酸发生突变的亚型在临床上可占到近20%,这部分的突变体对小分子激动剂响应能力大幅度降低,而PC7A高分子激动剂仍然表现出较高的免疫激活能力(图3c-e)。
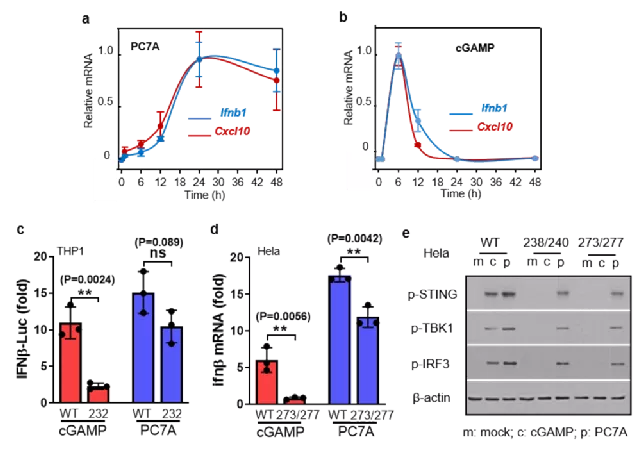
图3. PC7A具有缓慢而持久的免疫刺激活性,并对多种临床亚型表现出响应能力
要点3:结合高分子与小分子激动剂在动物及临床样本中取得良好免疫应答活性
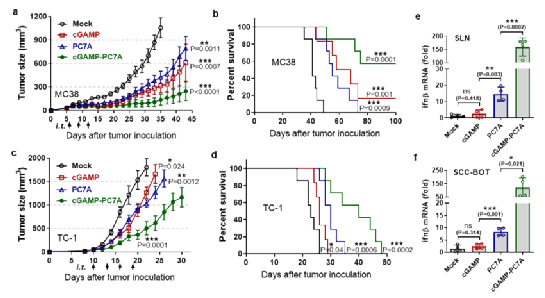
图4. 双重STING靶向制剂cGAMP-PC7A NPs具有良好的肿瘤免疫治疗能力
利用小分子(cGAMP)与高分子聚合物(PC7A)二者与STING的非竞争结合位点与互补的免疫激活时间曲线,作者将两种激动剂联用制备了对STING具有双重靶向作用的聚合物纳米颗粒(cGAMP-STING NPs)。所得药剂在多种荷瘤小鼠模型中均取得了显著的肿瘤抑制能力(图4a-d),当与PD-1抗体联用时在MC38结肠癌模型中更是表现出100%的抗肿瘤效果;在病人的离体肿瘤组织与淋巴样本中进行测试时亦展示了良好的免疫激活的临床转化潜力(图4e,f)。进一步机制研究发现,纳米制剂起效的靶点为宿主自身的STING信号通路而非肿瘤细胞所表达的STING,通过激活宿主的免疫系统最终由CD8 效应T细胞发挥抗肿瘤的能力。
小结:
本研究合成了一种高分子STING激动剂,通过多价结合诱导STING蛋白胶连发生相转变,进而激活免疫系统发挥抗肿瘤的功效。不同的结合模式导致了高分子激动剂产生异于小分子激动剂的作用位点、空间分布、以及时间-药效曲线,为下一代STING激动剂的开发提供了新思路。目前研究人员正在将所得结果进行临床转化。
本论文第一作者为李苏昕博士,通讯作者为高金明教授。
参考文献:
Li, S., Luo, M., Wang, Z. et al. Prolonged activation of innate immune pathways by a polyvalent STING agonist. Nat Biomed Eng (2021).
https://www.nature.com/articles/s41551-020-00675-9
通讯作者:

Prof. Jinming Gao是美国德克萨斯大学西南医学中心的教授。他带领的课题组的一项杰出成就是发明了“proton transistor” 技术,该技术可以数字化分析生物学和医学领域的酸信号。高教授与他的长期合作者,头颈癌外科医师Baran Sumer博士共同创立了OncoNano Medicine。荧光纳米颗粒传感器ONM-100已成功完成了对30位癌症患者的I期临床试验,并获得了FDA的快速批准,从而开始了全癌手术的II期试验。近年来,研究团队已进入免疫肿瘤学领域。STING纳米颗粒疫苗(ONM-500)是其另一项发明,已从CPRIT获得1540万美元,用于HPV诱导的癌症的T细胞免疫疗法。作为美国国家癌症研究所癌症月球计划的一部分,高教授及其团队最近获得了U54纳米免疫工程中心奖,以开发创新的纳米疗法来促进癌症免疫疗法。











