
第一作者:Wu Li
通讯作者:雷爱文、Matthias Beller、Angelika Brückner
通讯作者单位:武汉大学、莱布尼茨催化研究所
同位素标记(特别是氘代标记),是发展新型药物的重要手段,比如具体的用于代谢产物的鉴定和定量。因此人们发展了多种多样的方法学能够进行小批量合成选择性氘代化合物。
目前,由于发展氘代化合物能够作为活性药物,因此人们对大规模分子氘代方法学非常感兴趣。对于工业量级的氘代标记方法,需要发展可靠的、高活性、大规模合成方法学。
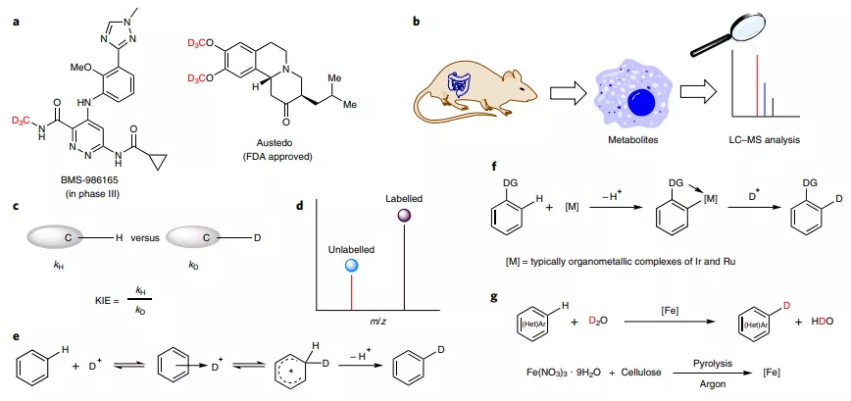
图1. 氘代的应用及氢氘交换方法
有鉴于此,莱布尼茨催化研究所Matthias Beller和Angelika Brückner,以及武汉大学雷爱文等报道通过纤维素和Fe盐合成的纳米铁催化剂能够对苯胺类、酚类、吲哚类,以及其他杂环化合物通过D2O作为氘代试剂,在氢气气氛中选择性的进行分子氘代标记。这种方法学具有容易大规模化合成的优势,能够进行千克量级大量合成氘代有机分子。反应中使用的催化剂具有空气气氛和水溶液稳定性,因此为高效率对有机分子进行氘代标记提供了一种直接有效的方法。

图2. 杂芳烃选择性氘代
研究背景
同位素标记是发展药物分子和农药的重要方法,比如在医药领域通常制备含同位素的活性药物分子,用于理解分子的代谢过程,鉴定其中特定的代谢物分子。氘原子是最常见的同位素标记原子,对于研究切断C-H、C-D键的动力学同位素效应(KIE)非常合适。与未标记的化合物相比,氘原子标记的化合物具有不同的分子量,因此能够作为内标试剂用于LC-MS分析。因此合成氘代有机分子具有非常重要的意义。特别是对芳基/杂芳基/有机胺进行标记变的非常重要,因为这种结构在大量的有机分子中都存在。
酸介导H/D交换是最古老的芳烃标记方法,但是这种反应只能通过亲电取代反应修饰结构简单的芳烃。基于均相金属催化C-H键活化,人们发展了一系列金属有机催化剂,能够对芳烃、脂肪胺的α,β位点进行H/D交换。比如Ir金属的Crabtree或者Kerr催化剂能够通过D2气体进行C(sp2)-H化学键的同位素标记,Fe的金属有机催化剂能够通过D2或者T2对药物活性分子的芳烃C-H键进行氘代或者氚代。最近MacMillan等发展了光催化同位素标记方法,能够对N-烷基胺药物分子标记。
除了光催化剂和有机金属均相催化剂,异相贵金属催化剂同样发展能够作为氘代标记催化,比如Pd/C和Pt/C催化剂能够对芳烃或者杂芳烃进行H/D交换。Ru或者Ir催化剂也得到发展用于D2进行标记,展示了非常吸引人的标记能力。
新发展
目前除了Ni金属,基本上目前发展的各种氘代标记异相催化剂都是基于贵金属,因此发展非贵金属催化剂具有更好的发展前景;同时,发展温和的氘代试剂,比如更加便宜安全和操作方便的D2O替代D2,是非常好的发展方向。
莱布尼茨催化研究所Matthias Beller和Angelika Brückner,以及武汉大学雷爱文等报道发展了异相非贵金属Fe基催化剂,对芳烃和杂芳烃实现了普适性的氘代反应。反应避免使用价格昂贵的D2,能够在H2气氛中以D2O作为氘代标记试剂,能够对一些代表性的药物和天然产物分子进行氘代反应。
反应情况
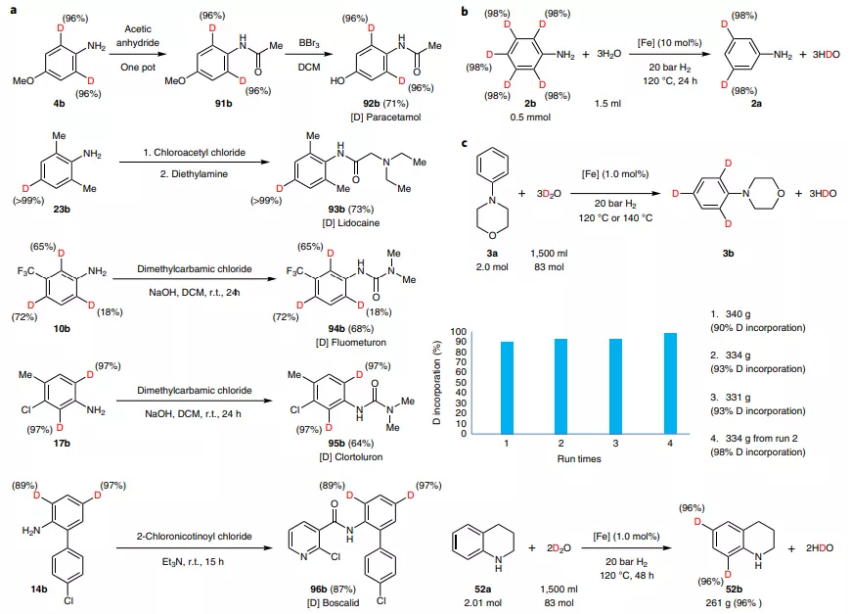
图3. 催化反应
催化剂的制备。通过热解Fe(NO3)3·9H2O和纤维素的混合物,得到高催化活性的选择性氢化试剂。
催化反应。这种催化剂能够对芳基环的邻位和对位实现氘代,而且催化剂的性能比Pt/C、Au/C、Ru/C催化剂具有更好的催化活性。当反应在氢气气氛中进行,氢化反应的性能进一步提高。通过XPS表征催化剂在催化反应过程中的界面变化情况,发现催化剂的表面部分还原为Fe(0)。优化反应条件,该反应能够在120 ℃的氢气中进行反应,以D2O作为氘代试剂,实现接近100 %的转化。
反应机理
通过动力学同位素效应(KIE)、ESR对反应机理进行研究,对比实验结果显示,H2O的反应速率比D2O的反应速率高4倍,在氘代反应的决速步骤是D-OD切断。通过对比苯胺、3,5-二氘代苯胺的氘代反应,发现微弱的二级KIE效应,这种区别来自于氘代与非氘代底物之间的配位环境有微弱区别导致。
通过ESR表征该反应是否通过自由基机理过程进行,发现使用DMPO自旋捕获剂,监测发现捕获··OD的DMPO-OD产物信号,说明催化剂能够促进一部分D2O分子以均裂方式切断D-OD。
通过相关表征提出反应的可能机理。首先催化剂以均裂方式切断D2O分子的D-OD化学键,生成的自由基物种吸附在催化剂表面转化为D*和OD*,随后与底物分子进行反应,*OD能够与芳环的氢反应生成HDO,生成苯环自由基,随后苯环自由基与D*生成氘代芳基产物。该反应中表现的邻位/对位选择性来自于电子浓度较高的铁催化剂能够向界面吸附芳烃传递电子浓度,因此能够促进亲电反应,实现邻位/对位取代。
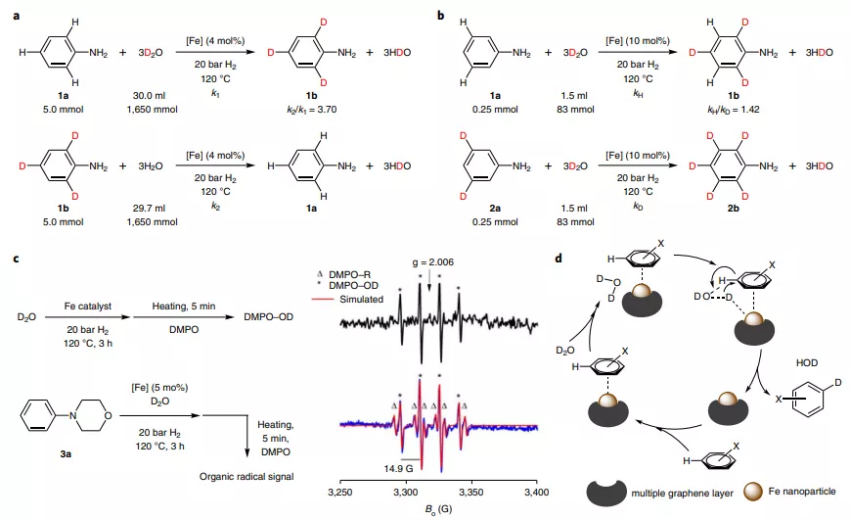
图4. 催化反应机理
参考文献及原文链接
Li, W., Rabeah, J., Bourriquen, F. et al. Scalable and selective deuteration of (hetero)arenes. Nat. Chem. (2022).
DOI: 10.1038/s41557-021-00846-4
https://www.nature.com/articles/s41557-021-00846-4











