研究背景:
在灵活性、可扩展性和弹性方面,日常生活是机器人的灵感来源。微三维(micro-3D)打印和合成生物学的最新进展提高了人们的期望,即直接使用生物分子自下而上设计纳米到微型生物机器人成为现实。
细胞运动蛋白可将代谢能直接转化为机械功,是自然界中很有希望在软材料上执行机械操作的候选材料。与机电和生物混合驱动装置相比,使用分子马达的一个关键挑战是提高驱动力和工作效率,以操作数量级更大的设备。最近,一种基于微管和驱动蛋白马达的大规模活性结构(类似于应力纤维)被成功构建,可直接使光激活部分在溶液中组装。然而,要生产具有更接近生物机动化系统的机器人结构,必须满足两个挑战:仿生模板的设计,既具有足够的可塑性,又在生理上与运动蛋白系统的大规模操作兼容,以及蛋白质马达和网络的特定位置连接,以支持复杂的机械操作。
基于以上思考,来自德国马克斯·普朗克生物化学研究所的Petra Schwille团队和阿诺德·索末菲尔德理论物理中心的Chase P. Broedersz团队描述了一种基于肌动球蛋白的皮质样力产生的替代方法,允许在可收缩的网状结构中进行低复杂度的运动,该网状结构可被包裹在软物体上,并由ATP局部激活。这种设计让人联想到一种从外部驱动的基于蛋白质的机器人结构的机动性外骨骼。它很容易将微型三维打印模块连接和组装成更大的结构,从而扩大机械工作。该研究提供了这些系统中力产生的分析模型,并通过执行复杂机械任务的三维打印单元(如微手和微阵列)演示了设计的灵活性,这些微手和微阵列可以在光激活后抓握和挥动。

研究思路:
外骨骼驱动机器人结构的概念:
蛋白质基模块化单元(图1a)组装成可变形机器人结构,这些单元涂有最小的肌动球蛋白外骨骼并由其驱动。机动外骨骼可视为一个放大的肌动球蛋白皮质层,通过特定的非共价相互作用连接可变形机器人结构的不同部分(图1b)。这种方法可以通过组合基本模块(如支柱、面板和铰链)来应用于更复杂的变形结构,从而模仿例如人手的关键元素(图1c)。最后,外骨骼设计可以扩展和放大,以实现主动机械设备的复杂可编程形状转换,并进一步实现具有(选择性)光激活模块的软机器人元件的多级功能(图1d)。
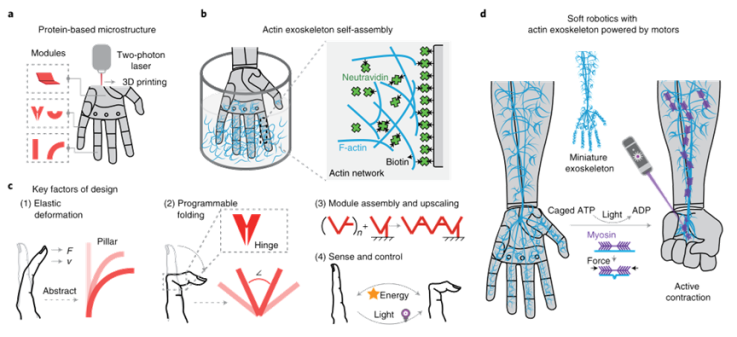
图1|由分子马达驱动的外骨骼的基于蛋白质的软机器人结构的关键设计概念
外骨骼收缩特性:
为了了解收缩机动外骨骼在基于3D蛋白质模块的变形中的力生成和传递等基本性能,研究人员首先设计了一个由十根软柱组成的环(图2a)。随后,通过生物素-肌动蛋白和中性亲和素偶联,将环状结构生物素化,并用肌动蛋白丝(F-actin)网状结构装饰。肌动蛋白细丝通过中和蛋白进一步交联,以增强网络的机械完整性(图2b)。
接下来,研究人员通过改变柱环的直径D,研究了3D结构的收缩性能(图2c、d)。为了探索弹性对肌动球蛋白外骨骼收缩能力的影响,研究人员在柱环试验中改变了柱的刚度,同时保持网的密度不变(图2e、f)。对于给定的肌动蛋白密度,力的产生在广泛支柱刚度范围内是稳健的(图2g)。为了理解这些力的累积,研究人员接下来研究了肌动球蛋白网络在微观结构上的收缩动力学。肌球蛋白激活后,柱子开始向内弯曲(图2h)。收缩速度最初在大约1分钟的过程中显著增加,然后向最终状态减速收缩(图2i)。收缩期间达到的最大速度取决于支柱刚度(图2j)。
收缩机制的机械反馈模型:
为了阐明所观察到的力产生和收缩动力学的机制,可以使用一个简单的一维(1D)分析模型来描述该收缩系统。在该粘性模型钟,肌球蛋白活性由作用在支柱上的时间依赖性收缩力表示(图2a)。粘性网络应力的缓慢累积和肌球蛋白结合动力学产生的主动力之间的固有正反馈导致了柱环复杂的收缩动力学,这与实验定量一致(图2i)。通过将模型拟合到一根支柱刚度处的单一收缩曲线,对其余参数进行了充分约束(图2i)。该模型准确预测了广泛支柱刚度范围内主动生成力的动力学和稳态值(图2e–g),包括收缩速度的刚度依赖性(图2j)。
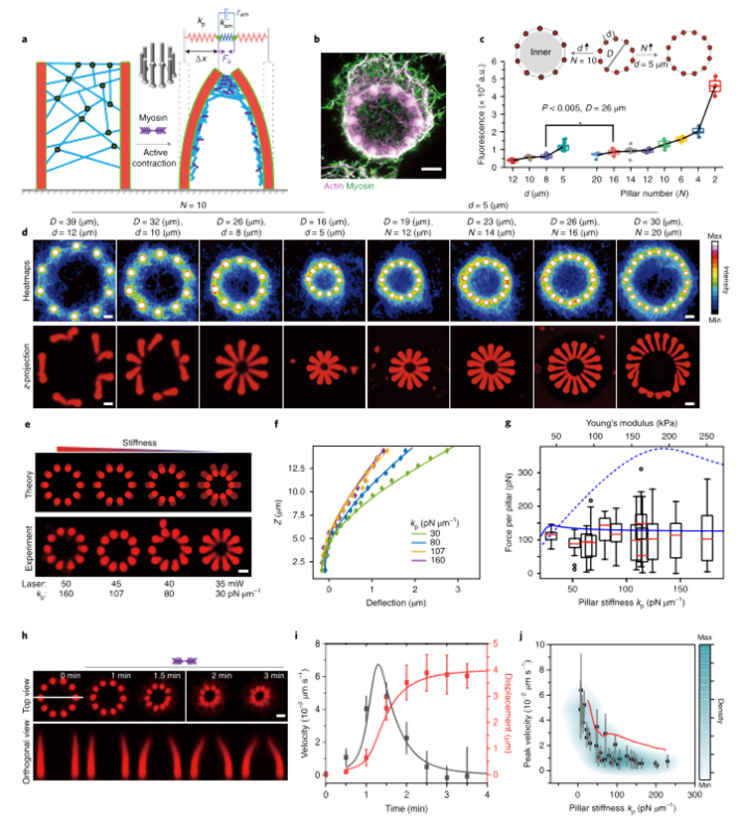
图2|基于支柱的模型系统,用于量化BSA水凝胶结构上收缩皮质产生的力
驱动复杂三维对象的空间变换:
在对具有简单几何形状的软框架上肌动球蛋白外骨骼的力产生和收缩动力学有了概念性的理解之后,接下来转向涉及复杂3D结构和可编程变换的应用。其核心思想是从具有可调刚度的模块组装3D结构,以执行可控变形。将复杂性提升到下一个层次的关键结构元素是铰链模块。因此,研究人员设计了一个V形铰链,其两个刚性臂(柱)通过软关节连接,以及一个稳定顶点,以防止过度拉伸到180°以上的角度(图3a)。V单元的主动闭合可在凸角范围内完成(图3b)。由于肌球蛋白马达的活动对ATP浓度很敏感,因此可通过在高ATP和低ATP条件之间切换来诱导可逆的形状转变(图3c)。较软的结构显示出较大的位移,但由于能量耗散较大,可逆性较低。因此,不同刚度的结构在位移和可逆性之间表现出相反的趋势(图3d)。

图3|通过切换ATP浓度实现铰接式3D V机组的可逆运行
肌动球蛋白驱动的机器人现在可以通过连接活动模块来设计更大的结构来实现机械工作的放大。具体而言,V单元被组合成一个之字形模块,V单元之间的连接点被稳定,只允许在底部接缝上折叠。然后,肌动球蛋白独立触发所有V单元的闭合,导致锯齿形模块快速卷曲(图4a)。由6个V单元组成的弹簧型之字形模组,可以围绕右边的第一个关节旋转,其长V链绕成环状向上盘绕,最终形成一个封闭的六角星(图4b)。主动仿生设备的另一个理想特征是能够将二维(2D)表面折叠成复杂的3D形状。为了实现这一点,研究人员扩展了方法,以生成更复杂的形状变形,例如由六个铰链板组成的十字前驱体自折叠水凝胶立方体(图4c、d)。为了进一步扩展复杂性机器人,研究人员创建了可编程和可逆的微型机器人。首先,使用生物驱动的3D蛋白水凝胶来模拟抓取微型手,包括一个带有五个手指的面板(图4e)。我们将微型手和V单元链结合起来,形成了一个微型机械臂——完全由蛋白质制成并由蛋白质驱动(图4g、h)。接下来,研究人员探讨了如何将人工手臂的运动设计为受多级控制的目标。正如预期的那样,由轻型预加载电机激活的复杂结构比从解决方案中招募电机和能量反应更快,这为未来提高系统性能提供了一条新途径。

图4|利用定向仿生驱动实现复杂三维结构的大规模变形
小结:
总之,该研究证明了3D打印基于蛋白质微型机器人的能力,并以最小的肌动球蛋白外骨骼作为其驱动系统。重组生物马达组件作为收缩层可进行高效和伸缩的操作,通过将化学能直接转化为机械功,使复杂的三维微结构能够大规模变形。此外,这种完全由生物分子自下而上设计和组装的自供电软机器人系统是作为底盘的绝佳起点。未来,在自动化的微流体下操作,通过优化肌动球蛋白网络的组成,在速度、力和可逆性方面的性能可能会得到提高。它不再依赖于材料的膨胀和收缩,框架内的栩栩如生的系统、自下向上的装配,将为各种应用开辟了新的前景,如定制形状的动态传感器和生物测定、用于体内生物医学任务的微型机器人和原生组织工程等。
参考文献:
H.Jia, J. Flommersfeld, M. Heymann, S.K. Vogel, H.G. Franquelim, D.B. Bruckner, H. Eto, C.P. Broedersz, P. Schwille, 3D printed protein-based robotic structures actuated by molecular motor assemblies, Nat Mater, 21 (2022) 703-709.
https://doi.org/10.1038/s41563-022-01258-6.











