1. AM:共轭聚合物纳米颗粒用于对脑和肿瘤血管的高分辨率三维近红外II区光声成像
外源性造影剂辅助的近红外II区高分辨光声显微镜成像(ORPAMI)具有深度穿透、高信噪比(SBR)和高成像分辨率等优点,有望可以用于对广域三维生物结构进行研究。新加坡国立大学刘斌教授团队报道了利用近红外II区共轭聚合物纳米颗粒(CP NP)进行ORPAMI可以用于对大脑和肿瘤血管的定位。CP NPs1161 nm波长具有48.1 L g-1的消光系数,其PA敏感性高达2µg mL-1。实验证明,利用CP对小鼠耳朵的三维ORPAMI可以清晰地显示出规则的血管结构,在最大成像深度为539 μm时SBR为29.3 dB,分辨率为19.2 μm。通过三维血管成像,可以清晰地勾画出致密血管构成的耳肿瘤的边缘。此外,该方法可以穿过完整的颅骨,实现清晰的三维全皮质脑血管结构成像,具有成像面积大(48 mm-2)、分辨率高(25.4 μm)和SBR高(22.3 dB)的优势。这一研究结果显著优于最近报道的三维近红外II区荧光共聚焦血管成像,也为近红外II区ORPAMI的生物医学应用开辟了新的途径。
Bing Guo, Chengbo Liu, Bin Liu. et al. High-Resolution 3D NIR-II Photoacoustic Imaging of Cerebral and Tumor Vasculatures Using Conjugated Polymer Nanoparticles as Contrast Agent. Advanced Materials. 2019
DOI: 10.1002/adma.201808355
https://doi.org/10.1002/adma.201808355
2. AM:用于生物医学领域的MOF机器人
可动型MOF材料是一种可用于环境修复、靶向药物递送和纳米级外科手术的小型机器人平台。苏黎世联邦理工学院Josep Puigmartí-Luis团队成功地制备了一种具有良好生物相容性和对pH响应特性的ZIF-8磁性螺旋结构。结果表明,在弱的旋转磁场控制下,这种高度集成的多功能材料可以沿着预先设计好的轨迹游动。结果证明,该系统可以在细胞培养基中实现单细胞靶向,并在复杂的微流体通道网络中实现对载荷的控制性递送。
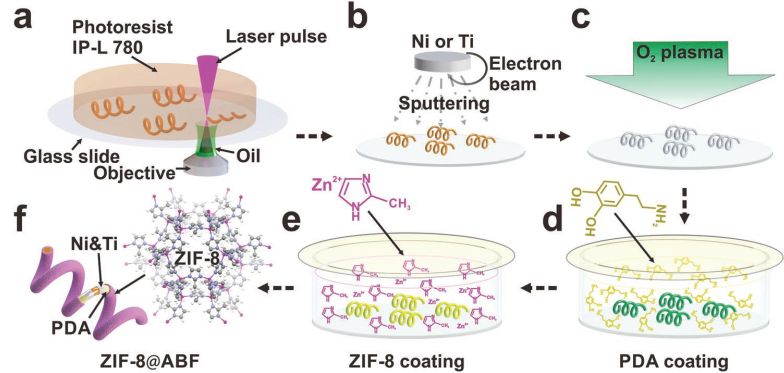
Xiaopu Wang, Josep Puigmartí-Luis. et al. MOFBOTS: Metal–Organic-Framework-Based Biomedical Microrobots. Advanced Materials. 2019
DOI: 10.1002/adma.201901592
https://doi.org/10.1002/adma.201901592
3. Nano Lett.:靶向深部胰腺癌微环境的共递送纳米系统
胰腺导管腺癌(PDAC)因其独特的微环境而被认为是最具侵袭性的恶性肿瘤之一,其主要病理组织学特征是间质促纤维增生,它约占肿瘤体积的80%。间质促纤维增生对于药物扩散和T细胞渗透有着负面影响,且会形成免疫抑制的微环境。然而,这种独特的微环境也可以通过抑制邻近效应来限制胰腺癌的物理扩散。复旦大学蒋晨教授团队采用靶向肿瘤中心基质和微环境响应的策略制备了共负载紫杉醇和磷酸化吉西他滨的纳米颗粒。该纳米颗粒会破坏中心基质从而提高了化疗药物的抗肿瘤效果。另外,该纳米颗粒可以通过增加细胞毒性T细胞的数量和抑制调节性T细胞的百分比来调节免疫抑制的肿瘤微环境。而相对完整的细胞外基质也能有效抑制邻近作用以防止肿瘤转移。这一研究将基质靶向与刺激响应型聚合物纳米材料递送策略相结合,为开发有效的肿瘤靶向药物传递系统提供了新的方法。
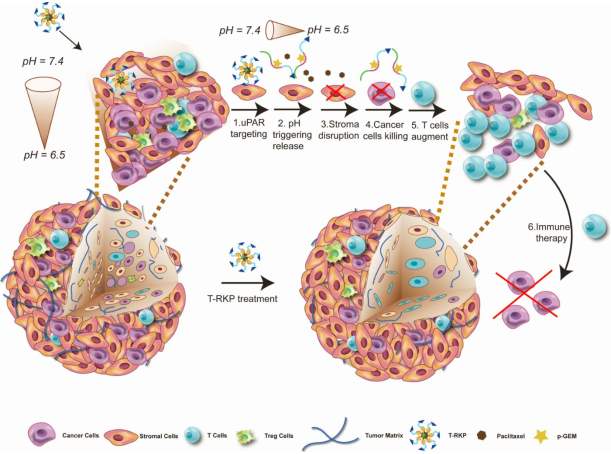
Xinli Chen, Chen Jiang. et al. A codelivery nanosystem targeting the deep microenvironment of pancreatic cancer. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00374
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00374
4. PNAS:利用靶向细胞外基质的纳米体对肿瘤发展、转移和纤维化进行无创成像
细胞外基质(ECM)沉积是许多疾病的一个标志。为了将ECM作为成像和治疗的靶点,麻省理工学院Richard O. Hynes团队开发了来源于羊驼、针对疾病相关ECM蛋白的纳米体。实验通过非侵入性的体内免疫PEC /CT成像显示,NJB2在多种乳腺癌模型,例如人类和小鼠三阴性乳腺癌和黑色素瘤中都能准确检测到原发肿瘤和转移部位,且具有良好的特异性。另外,NJB2不仅对小鼠胰腺导管腺癌(PDAC)进行成像,它还能够检测PDAC肿瘤早期的胰腺病变(胰腺上皮内瘤)的形成,且具有优良的清晰度和信噪比。最后,NJB2还可以在博莱霉素诱导的纤维化模型中检测到肺纤维化部位,因此NJB2和类似的抗ECM纳米体可作为无创检测原发肿瘤、转移病灶和纤维化的有效工具。
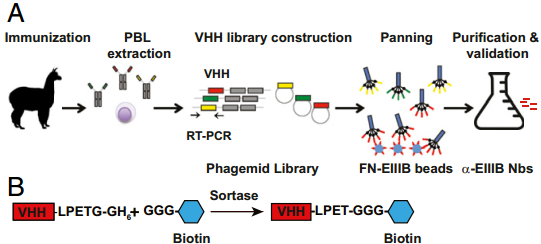
Noor Jailkhani, Jessica R. Ingram, Richard O. Hynes. et al. Noninvasive imaging of tumor progression, metastasis, and fibrosis using a nanobody targeting the extracellular matrix. Proceedings of the National Academy of Sciences of the United States of America. 2019
https://www.pnas.org/content/early/2019/05/07/1817442116
5. ACS Nano:纳米颗粒可下调骨质疏松相关基因以促进成骨标志物表达
骨质疏松症是最常见的骨变性疾病。但目前的临床治疗都不能实现令人满意的疗效。SOST基因会抑制Wnt信号通路,降低成骨细胞分化。因此,用特定的siRNA沉默SOST基因是治疗骨质疏松症的一个有效选择。但是siRNAs有很短的半衰期和较差的转染能力,因此需要一个有效的载体对其进行递送。西班牙马德里康普顿斯大学Miguel Manzano团队和María Vallet-Regí团队合作,利用具有高负载能力的聚乙亚胺包裹的介孔二氧化硅纳米颗粒(MSNs)的去在细胞内递送骨生成抑制素和SOST siRNA,从而协同增强成骨标志物的表达,进而有效治疗骨质疏松症。
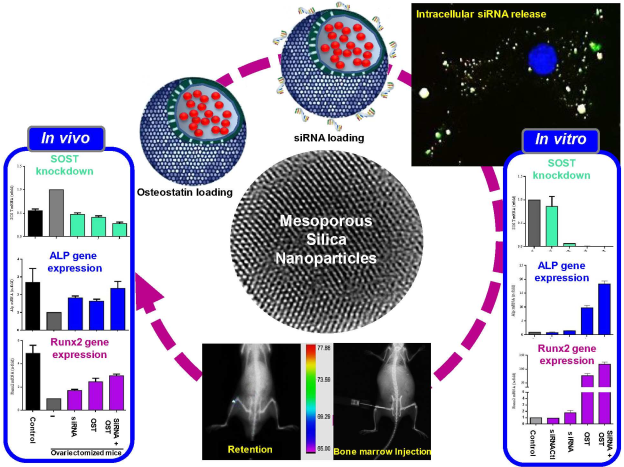
Patricia Mora-Raimundo, Miguel Manzano, María Vallet-Regí. et al. Gene and Promote Osteogenic Markers Expression for Osteoporosis Treatment. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00241
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b00241
6. 郭少军AFM综述:黑磷在生物医学和生物传感方面的研究进展
黑磷(BP)纳米材料包括BP纳米片、BP量子点和BP纳米颗粒。纳米BP具有优异的表面活性、可调节的带隙、高的载流子迁移率、很高的生物相容性和良好的生物降解性等特性,因此纳米BP在生物医学和生物传感领域具有很高的应用价值。北京大学郭少军团队综述了近年来纳米BP的合成、功能化及其在生物医学和生物传感等领域的研究进展。作者首先介绍了制备纳米BP的各种方法,如机械法、液相超声剥落法、电化学剥落法等等,并在此基础上提出了两种提高纳米BP稳定性的方法;其次阐述了纳米BP的生物成像(荧光成像、热成像、光声成像)、疾病治疗(光学治疗、光/化学/免疫协同治疗)及作为纳米载体和纳米药物的应用;随后介绍了纳米BP在生物传感方面的应用,包括电化学生物传感、荧光生物传感和化学发光生物传感等等;最后也对纳米BP在生物领域的应用前景进行了展望。
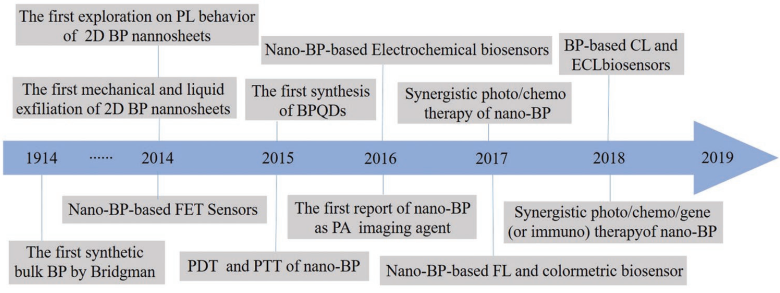
Xiaoxiao Ge, Shaojun Guo. et al. Recent Advances on Black Phosphorus for Biomedicine and Biosensing. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201900318
https://doi.org/10.1002/adfm.201900318
7. 游正伟AFM:具有多种保护功能的仿生材料
天然组织具有良好的材料特性,如自愈性、机械稳定性和可以帮助生物体在危险环境中适应和生存的机械梯度。而如何使得合成材料具有这些仿生保护功能则仍然是目前的一个难题。东华大学游正伟教授团队利用丁二酮肟-氨基甲酸乙酯(DOU)来制备多功能聚氨酯(DOU-PU)。DOU具有可逆解离、可金属配位、光解自愈、高强度韧性、形成机械梯度和可控功能化等优点。实验通过引入DOU制备了一种多功能的保护膜,它具有优异的抵抗机械损伤能力,室温下自愈合和防伪功能等特性。因此,这种超级仿生膜材料有望在电子学及对文凭、货币、汽车等各类贵重物品的保护中起到重要作用。
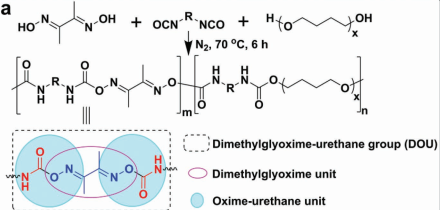
Zenghe Liu, Zhengwei You. et al. Biomimetic Materials with Multiple Protective Functionalities. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901058
https://doi.org/10.1002/adfm.201901058
8. AM:基于响应乏氧蛋白的纳米系统用于深入治疗肿瘤
肿瘤细胞的增殖处于近乎失控的状态,会造成内源性氧供应不足从而导致肿瘤组织乏氧。南洋理工大学赵彦利团队和苏州大学刘庄教授团队合作报道了一种响应乏氧的基于人血清白蛋白(HSA)的纳米系统(HCHOA),它是利用对乏氧敏感的偶氮苯基团去交联Ce6偶联的HSA和与奥沙利铂前药偶联的HSA而成。HCHOA纳米系统在正常氧浓度下是稳定的,尺寸为100-150nm。当暴露于乏氧的肿瘤微环境时,该纳米系统可以迅速分解为直径小于10 nm的超小HC和HO治疗性纳米颗粒,进而显著提高它们在肿瘤内的穿透能力。HC纳米粒子中Ce6的可用于生物成像和作为光敏剂产生单线态氧。因此该系统可以实现光动力治疗与化疗相结合的体内深度抗肿瘤效应。
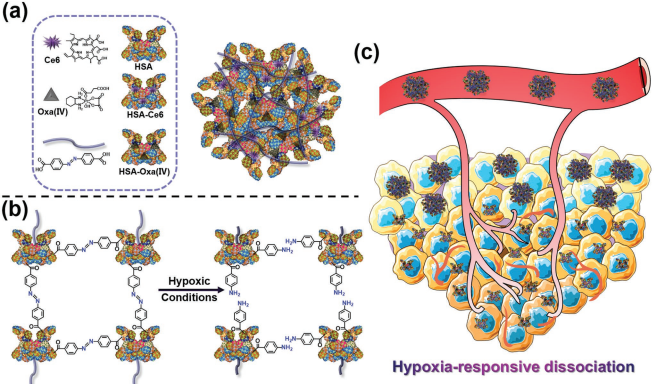
Guangbao Yang, Zhuang Liu, Yanli Zhao. et al. A Hypoxia-Responsive Albumin-Based Nanosystem for Deep Tumor Penetration and Excellent Therapeutic Efficacy. Advanced Materials. 2019
DOI: 10.1002/adma.201901513
https://doi.org/10.1002/adma.201901513
9. Nano Lett.:在肿瘤均匀分布的磁性铁氧纳米材料用于MRI/MPI和磁热治疗
磁热治疗所面临的两个主要难题是定量评估给药期间和给药后的药物分布以及在不损伤周围组织的情况下实现肿瘤的均匀热疗。中科院自动化研究所田捷团队和国家纳米科学中心梁兴杰团队合作开发了一种具有活性生物靶向作用的多模态MRI/MPI诊疗系统用于进行改善的磁热治疗(MHT)。该系统具有增强的磁共振成像(MRI)和磁粒子成像(MPI)效应,并且研究发现18纳米的氧化铁NPs (IOs)可以作为一种高性能的体外MRI / MPI造影剂。为了提高其递送的均匀性,实验使用肿瘤靶向肽CREKA对18纳米IOs进行修饰使其可以靶向肿瘤。MRI/MPI结果显示,靶向剂可以显著改善纳米颗粒在4T1原位小鼠乳腺癌肿瘤中的递送均匀性。治疗结果显示,通过提高靶向性和递送均匀性可以使得该系统比其他非靶向的IOs具有更好的肿瘤磁热治疗效率。
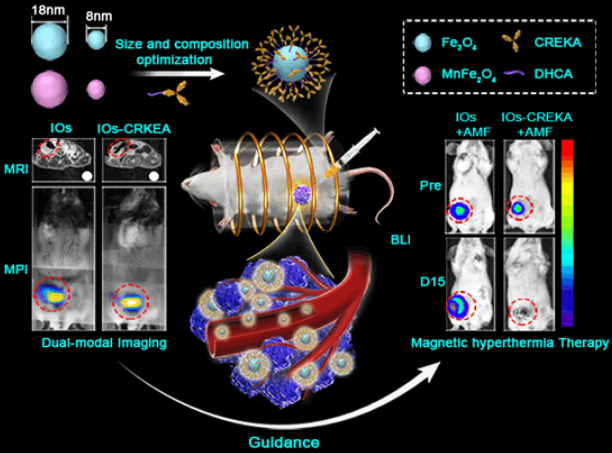
Yang Du, Xiaoli Liu, Qian Liang, Xing-Jie Liang, Jie Tian. Optimization and Design of Magnetic Ferrite Nanoparticles with Uniform Tumor Distribution for Highly Sensitive MRI/MPI Performance and Improved Magnetic Hyperthermia Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00630
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00630
10. AFM:组织特异性细胞外基质微球用于增强重编程细胞治疗
微球可以作为细胞培养的有效载体和细胞移植的支架材料。然而,由于缺乏生物功能和组织特异性,目前可用于制备微球的聚合物还十分有限。延世大学Seung-Woo Cho团队和高丽大学Ki Wan Bong团队合作报道了一种可提供组织特异性微环境的组织微球用于细胞培养并促进细胞治疗。实验利用流聚焦微流控装置和不同的细胞外基质(ECM)制备了大小均匀的组织微球,并将其用于特异性地包封诱发型肝细胞(iHep)、诱发型心脏细胞(iCar)和诱发型肌源细胞(iMyo),这些细胞都是直接由小鼠原代成纤维细胞重新编程得到的。与使用单一ECM的传统微球相比,组织特异性微球可以显著增强每一种重组细胞的活性、特异性成熟和功能。实验利用该组织微珠去介导重组细胞(iHep和iMyo)在体内的移植,可以进一步增强细胞治疗,并促进组织缺陷动物模型的功能组织再生。
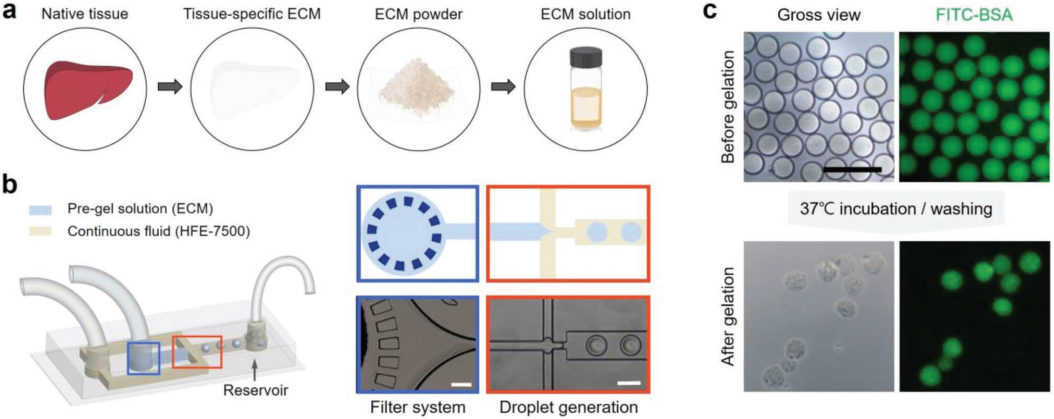
Jung Seung Lee, Ki Wan Bong, Seung-Woo Cho. et al. Tissue Beads: Tissue-Specifc Extracellular Matrix Microbeads to Potentiate Reprogrammed Cell-Based Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201807803
https://doi.org/10.1002/adfm.201807803
11. ACS Nano:配体修饰的细胞膜辅助药物纳米晶体靶向胶质瘤
安全有效地递送化疗药物是化疗抗癌的关键。复旦大学陆伟跃教授团队和加州大学圣地亚哥分校张良方教授团队合作制备了一种基于配体修饰的细胞膜和药物纳米晶体(NCs)的靶向药物递送系统。实验利用红细胞(RBC)膜去包裹药物纳米晶体NCs得到RBC-NCs,其具有高载药量、高的长期稳定性、良好的生物相容性和较长的循环时间,适合用于进行有效的药物递送。而经肿瘤靶向肽c(RGDyK)修饰后的RGD-RBC-NCs对皮下肿瘤小鼠和原位胶质瘤均有较好的肿瘤积累和治疗效果。
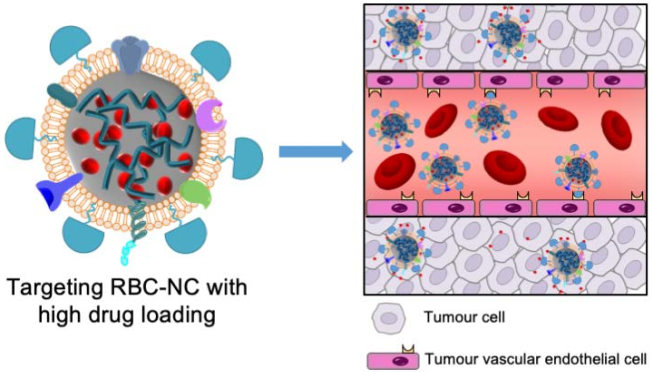
Zhilan Chai, Liangfang Zhang, Weiyue Lu. et al. Ligand-Modified Cell Membrane Enables Targeted Delivery of Drug Nanocrystals to Glioma. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00661
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b00661
12. Angew:Cu-TCPP在乏氧肿瘤中通过Russell机制产生单线态氧和消耗GSH用于癌症治疗
光动力治疗过程中的单线态氧(1O2)的生成受到光、光敏剂和氧等多因素的限制,而肿瘤细胞中谷胱甘肽(GSH)水平的升高也会影响治疗的效果。中科院长春应化所姜秀娥团队制备了一种超薄的二维Cu-TCPP纳米片用于选择性地在肿瘤微环境中生成1O2。过氧化氢会对TCPP配体进行过氧化反应,随后在类过氧化物酶纳米片和Cu2+作用下还原产生过氧自由基并进行自发复合反应产生1O2。此外,该纳米片也会消耗肿瘤内的谷胱甘肽来进一步提高治疗效果。因此,Cu-TCPP纳米片可以高效地、有选择性地破坏肿瘤,为克服目前光动力治疗的局限性提供了一种新的方法。
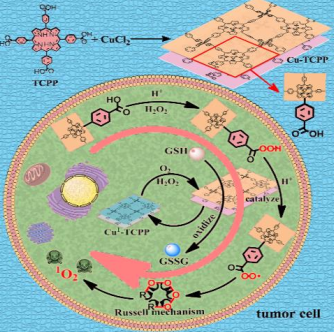
Chao Wang, Xiue Jiang. et al. Specifically Generation of Singlet Oxygen via Russell Mechanism in Hypoxic Tumor and GSH Depletion by Cu-TCPP Nanosheets for Cancer Therapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201903981
http://dx.doi.org/10.1002/anie.201903981
13. Chem. Soc. Rev:生物分子辅助的纳米结构磷酸钙绿色合成及其生物医学应用
磷酸钙(Caps)广泛存在于自然界和脊椎动物的骨骼牙齿中,具有很好的生物相容性,在生物医学领域有着广阔的应用前景。纳米磷酸钙(NCaPs)具有比表面积大、对pH响应的降解性好、载药量大、缓释性能好等优点,被认为是一种很有前景的药物/基因/蛋白载体。为了控制NCaPs的结构和表面性质,研究人员在合成中采用了核酸、蛋白质、多肽、脂质体和含磷生物分子等多种具有高生物相容性的生物分子进行辅助。这些生物分子在不同的合成过程中发挥着重要的作用,最终对生成的NCaPs的大小和形态产生影响。中科院上海硅酸盐所朱英杰研究员团队和北卡罗来纳大学黄力夫教授团队合作综述了生物分子在NCaPs合成中的重要作用,以期为NCaPs的设计和控制合成提供帮助;同时也总结了NCaPs在纳米医学和组织工程中的应用,并讨论其目前的研究趋势和对未来的发展进行了展望。
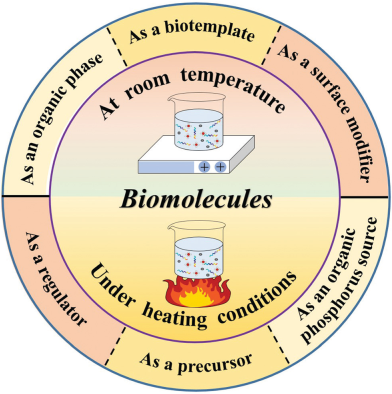
Chao Qi, Ying-Jie Zhu, Leaf Huang. et al. Biomolecule-assisted green synthesis of nanostructured calcium phosphates and their biomedical applications. Chemical Society Reviews. 2019
DOI:10.1039/C8CS00489G
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c8cs00489g#!divAbstract
14. ACS Nano:高生物相容性纳米团簇用于磁热治疗
纳米颗粒介导的磁热治疗具有良好的应用潜力,但是它仍然仅限用于局部和相对容易治疗的肿瘤。要进一步提高磁热治疗的应用价值,需要开发可以在全身给药后能在肿瘤部位有效积累,且在处于交变磁场中可产生理想的瘤内温度(AMF)的纳米材料。俄勒冈州立大学Olena Taratula团队和Oleh Taratula团队合作开发了一种高效的磁性纳米团簇可提高磁热效率。实验将由钴和锰掺杂的六边形氧化铁纳米颗粒(CoMn-IONP)包裹在生物相容性材料PEG-PCL中来系统地用于磁性热疗。研究表明这一纳米团簇基本无毒,在静脉注射后其能够有效地在卵巢癌肿瘤中积累,并利用磁热响应将瘤内温度提高到44℃,进而显著抑制肿瘤生长。
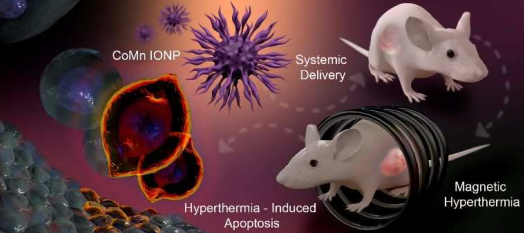
Hassan A Albarqi, Olena Taratula, Oleh Taratula. et al. Biocompatible Nanoclusters with High Heating Efficiency for Systemically Delivered Magnetic Hyperthermia. ACS Nano. 2019
DOI: 10.1021/acsnano.8b06542
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.8b06542
15. Nano Lett.:可清除一氧化氮的纳米凝胶用于治疗类风湿性关节炎
一氧化氮(NO)是由一氧化氮合酶(NOS)产生的自由基气体分子,在人体中起着重要作用。然而,当内源性NO因生理失调而过量产生时,会引发类风湿关节炎(RA)等严重的炎症性疾病。因此,清除NO是治疗炎症性疾病的一种有效策略。韩国浦项工科大学Won Jong Kim团队进一步评估了清除NO的纳米水凝胶(NO-Scv)用于治疗RA的效果。实验采用丙烯酰胺与NO清除交联剂(NOCCL)溶液进行聚合制备了NO-Scv凝胶。实验结果表明,NO-Scv凝胶可通过清除NO降低炎症水平,且具有良好的生物相容性。与地塞米松(一种商业药物)相比,NO-Scv凝胶在小鼠模型上抑制RA的治疗效果也更为显著。
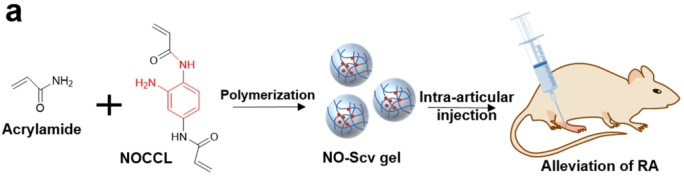
Jiwon Yeo, Yeong Mi Lee, Won Jong Kim. et al. Nitric Oxide-Scavenging Nanogel for Treating Rheumatoid Arthritis. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00496
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00496
16. AM:仿生制备粘弹性胶囊及其应用
微胶囊常被用作活性成分的载体以保护其不与周围物质发生过早的反应。瑞士洛桑联邦高等理工学院Esther Amstad团队将微胶囊作为具有良好颗粒结构的宏观三维材料的主要构件。该胶囊是由被儿茶酚(用于金属配位)功能化的嵌段共聚物表面活性剂组成的。这些表面活性剂会在乳液滴的表面发生自组装,通过离子交联形成具有低渗透性粘弹性胶囊。结果表明,该胶囊具有良好的机械强度、柔韧性和黏性,因此可以将其用于构建宏观的颗粒结构,进而为设计开发3D打印的柔软自愈材料提供了新的方法。
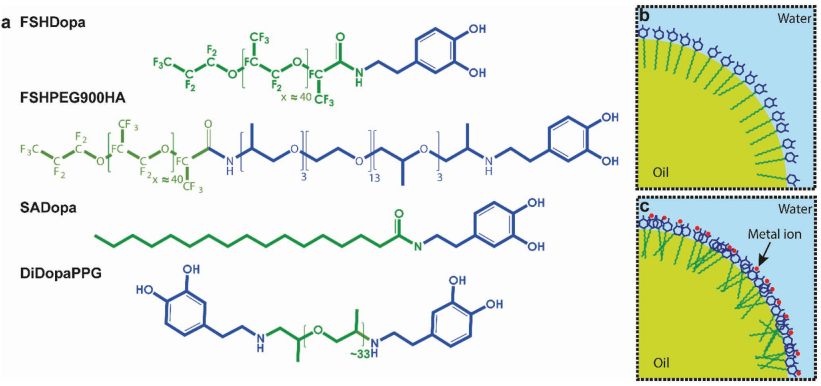
Gianluca Etienne, Esther Amstad. et al. Bioinspired Viscoelastic Capsules: Delivery Vehicles and Beyond. Advanced Materials. 2019
DOI: 10.1002/adma.201808233
https://doi.org/10.1002/adma.201808233
17. ACS Nano综述:非层状溶性液晶脂质纳米粒子作为一代纳米药物
非层状溶性液晶(LLC)脂质纳米材料是一种具有良好发展前景的新型纳米药物材料。其中,溶性液晶脂质纳米颗粒(LCNPs)作为各种疏水/亲水性小分子药物、多肽、蛋白质、siRNA、DNA和显像剂的纳米载体受到了研究的广泛关注。墨尔本皇家理工大学Calum J. Drummond团队对将LCNPs作为药物递送的纳米载体的好处和优势进行了概述;介绍了将LCNPs设计成为药物载体的基本原则和所需功能;通过50多个临床前研究案例对LCNPs的材料-生物界面进行了阐述;并最后对LCNPs的专利及临床转化研究进行了介绍。这对于指导未来开发基于LCNPs的药物递送纳米载体将大有帮助,实现将其作为下一代用于疾病治疗和诊断的纳米药物平台的目标。
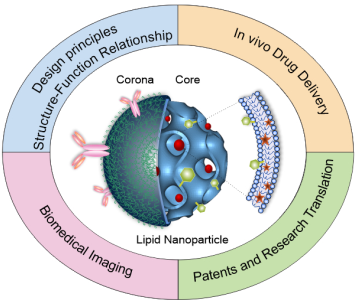
Jiali Zhai, Calum J. Drummond. et al. Non-Lamellar Lyotropic Liquid Crystalline Lipid Nanoparticles for the Next Generation of Nanomedicine. ACS Nano. 2019
DOI: 10.1021/acsnano.8b07961
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.8b07961
18. Nature Commun.:基于单肽-MHC的纳米药物治疗多种肝脏自身免疫性疾病
基于具有组织特异性和自身抗原表位的,以肽为主的组织相容性复合体II (pMHCII)纳米药物可通过将同源抗原感受性CD4+T细胞重新编程为疾病抑制T-调节型(TR1)细胞来降低特异性自身免疫条件。卡尔加里大学Pere Santamaria团队研究表明,基于单肽-MHC的纳米药物可以呈递与原发性胆汁胆管炎(PBC)或自身免疫性肝炎(AIH)相关的表位抗原,进而可以组织特异性地抑制PBC、AIH和原发性硬化性胆管炎。治疗效果则与同源TR1细胞的形成和扩张、TR1细胞在肝脏的富集和淋巴结引流、局部B调节细胞的形成以及对肝脏和肝近端髓样树突状细胞和枯否细胞促炎能力的深度抑制有关。
Channakeshava Sokke Umeshappa, Pere Santamaria. et al. Suppression of a broad spectrum of liver autoimmune pathologies by single peptide-MHC-based nanomedicines. Nature Communications. 2019
https://doi.org/10.1038/s41467-019-09893-5
19. JACS:光控制产生单线态氧用于癌症治疗
无创控制单线态氧(1O2)的可逆生成对于光动力治疗具有重要的实际意义。华东师范大学田阳教授团队和陈丽君、杨海波教授团队合作,以光敏剂和光致变色材料为功能模块开发了一种新型的双级金属环(M),它可以通过有效的分子内能量转移实现对1O2生成的无创控制。由于功能模块在金属环支架内的近端位置,光致变色组分(C-M)在环闭合状态下的1O2生成会被光诱导的能量转移猝灭,而环开状态(O-M)下的1O2生成则会在光照下被激活。而负载该金属环的纳米颗粒具有较高的稳定性和水溶性,可以通过内吞作用将金属环递送给癌细胞。在光照下,开环型纳米颗粒(O-NPs)对癌细胞的细胞毒性明显高于闭环型纳米颗粒(C-NPs)。体内实验也表明,该纳米粒子可在光照下非常有效地消除肿瘤,并具有光控调节体内单态氧生成的能力。
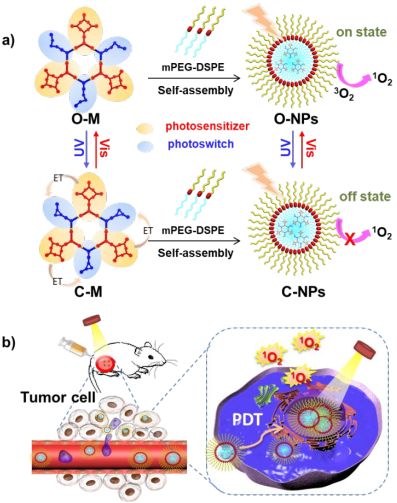
Yi Qin, Li-Jun Chen, Yang Tian, Hai-Bo Yang. et al. Light-Controlled Generation of Singlet Oxygen within a Discrete Dual-Stage Metallacycle for Cancer Therapy. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.9b02726
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.9b02726
20. ACS Nano:光活化铂纳米复合物用于选择性和协同治疗癌症
纳米结构对于实现肿瘤精准化疗和减小副作用来说具有重要的意义。华中科技大学赵彦兵团队、杨祥良团队和苏州大学陈华兵教授团队合作设计了一种双功能光活化铂纳米复合物(PtNCs),可以实现具有时空选择性的热-化学协同肿瘤治疗。实验以Pt4+配位聚羧酸纳米凝胶为模板,通过简单、可控的还原反应合成了由零价Pt0核及其周围的二价Pt2+壳层组成的双功能PtNCs。在没有光照的情况下,化疗药物Pt2+离子会与PtNCs表面紧密结合,有效地减少了药物的不良泄漏和对正常组织/细胞的非选择性损伤。而在光照射下,PtNCs会利用Pt0核的光热转换产生大量热量,同时引发化疗药物Pt2+离子的快速释放,从而产生光活化的热-化学协同治疗效应。此外,PtNCs在被注射后立即暴露于光照下会通过热致亲疏水性转变增强其在肿瘤的累积,进而通过协同治疗显著体内肿瘤。
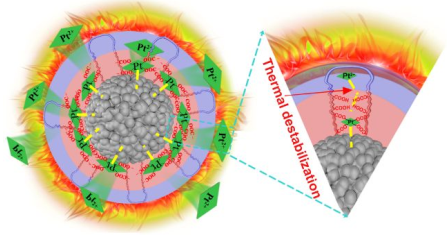
Hao Zhao, Yanbing Zhao, Huabing Chen, Xiangliang Yang. et al. Spatiotemporally Light-Activatable Platinum Nanocomplexes for Selective and Cooperative Cancer Therapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00972
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b00972
21. Nano Lett.:协同催化增强声动力和光热治疗癌症
超声(US)触发声动力治疗(SDT)作为一种非侵入性的治疗方式,可以克服传统光动力治疗(PDT)在抗癌应用的不足,具有广阔的应用前景。然而,在无氧(O2)辅助的条件下,SDT的疗效仍不能令人满意。因此开发基于SDT的协同治疗模式的还有很大的探索空间。中科院长春应化所程子泳团队和林君团队合作设计了一种由中空半导体CuS和贵金属铂组成的新型Pt-CuS Janus材料。该材料的空腔较大,可用于负载声敏剂分子以实现SDT。此外,Pt组分不仅可以提高CuS的光性能,而且还使得该材料拥有纳米酶的活性,可催化分解过氧化氢(H2O2)来产生氧气,可以克服肿瘤乏氧和增加SDT诱导的活性氧(ROS)产生。并且在808 nm激光照射下,Pt-CuS产生的热量也可以提高Pt的催化活性来进一步改善SDT的疗效。而包覆在Janus材料周围的热敏共聚物可以作为一个智能开关去调节Pt的催化能力和控制TAPP的释放,对调节治疗效果也有显著作用。实验结果表明这种协同催化模式可以同时提高SDT和光热治疗的效率,可以实现对肿瘤的完全治愈,无明显复发,同时也具有较高的治疗生物安全性。此外,该Pt-CuS Janus材料也是一种很好的光声(PA)和近红外热成像造影剂。
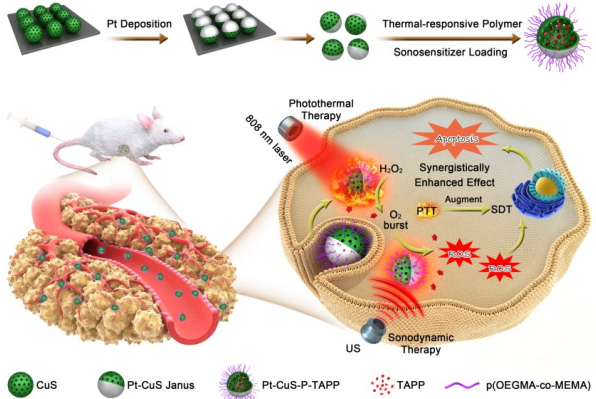
Shuang Liang, Ziyong Cheng, Jun Lin. et al. Synergistic Catalysis-Enhanced Sonodynamic and Photothermal Cancer Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01595
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b01595











